159. Substancja komórkowa
Substancja komórkowa organizuje poszczególne komórki w tkanki i pomaga regulować funkcje tkanek przez szlaki sygnalizacyjne. ECM bierze udział w rozwoju tkanek i jest konieczna do gojenia się ran. Składa się głównie z trzech typów związków:
proteoglikanów - lepkich glikoprotein, które działają jako amortyzacja między komórkami oraz wiążą wiele innych czynników międzykomórkowych
włókien różnych form kolagenu - których głównym zdaniem jest nadawanie wytrzymałości mechanicznej
multiadhezyjnych białek macierzy, które sieciują inne filamenty i są rozpoznawane przez receptory na powierzchni komórek
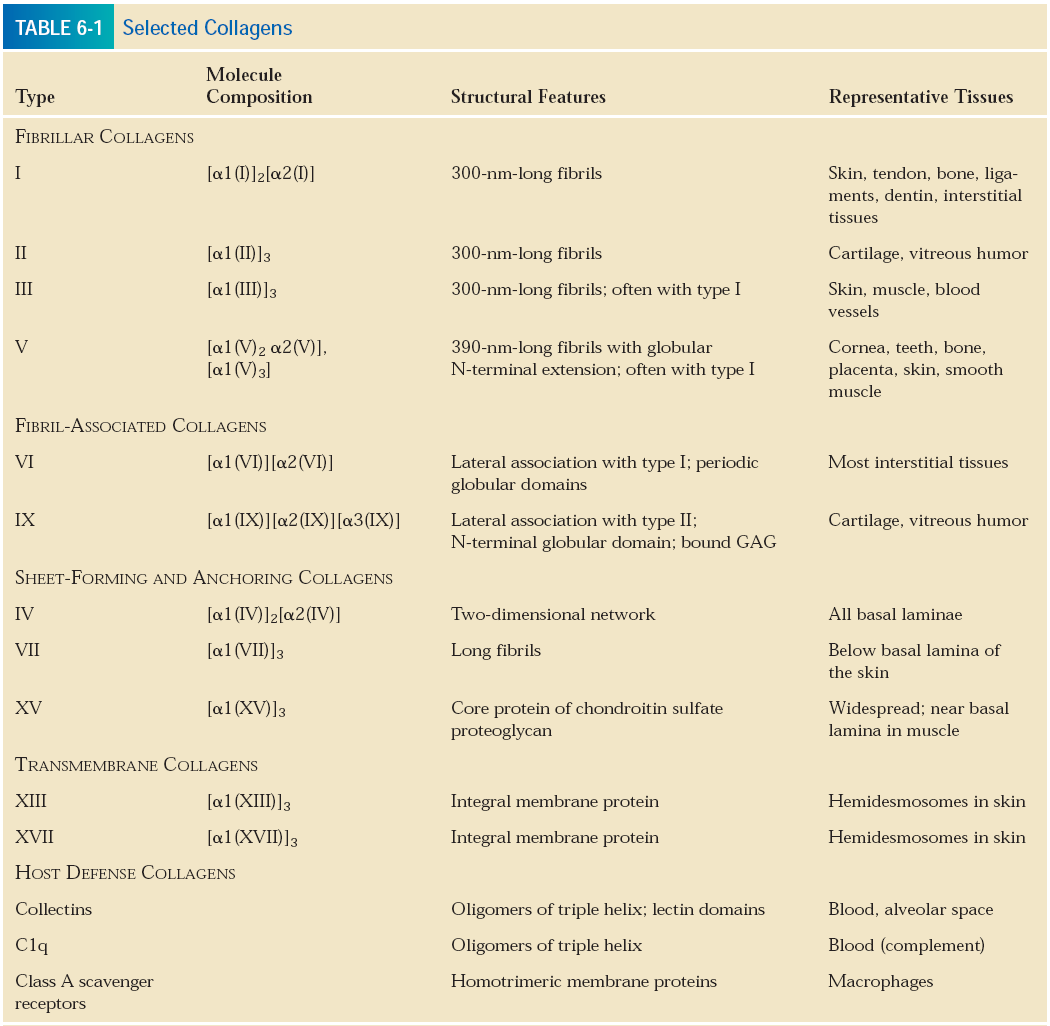
Każda tkana ma ECM o innym składzie, różnią się rodzajem proteoglikanów, których jest multum, oraz obecnymi formami kolagenu, które mogą tworzyć dwuwymiarowe, płaskie sieci (np. kolagen IV w blaszce podstawnej) lub długie struktury włókniste ( np. kolagen I, II i III w ECM tkanek łącznych). ECM nabłonka tworzy płaską, cienką blaszkę podstawną, która podtrzymuje nabłonek i pomaga zachować właściwy kształt i integralność narządów. ECM tkanek łącznych zajmuje większość objętości tych tkanek i zawiera hialuronian - wyjątkowy glikozaminoglikan, charakterystyczny tylko dla tej tkanki, spełniający rolę amortyzacji stresów mechanicznych. W tabelce przedstawiono różne formy kolagenu.
160. Blaszka podstawna
Blaszka podstawna to cienka, płaska struktura ECM kontaktująca się z komórkami nabłonka od strony bazalnej. Podtrzymuje ona nabłonek i utrzymuje właściwy kształt tej tkanki oraz bierze udział w kontaktowaniu się komórek nabłonka z leżącą pod spodem tkanką łączną. Komórki nabłonka przyczepione są do składników blaszki podstawnej za pomocą hemidesmosomów. Blaszka podstawna składa się z 4 głównych elementów:
dwuwymiarowej sieci kolagenu typu IV, składające się potrójnych lewoskrętnych helis kolagenu (trzy cząsteczki kolagenu asocjują bokami alfa helikalnych domen tworząc lewoskrętną potrójną helisę.
Sieci białek multiadhezyjnych zwanych lamininami, która łączy się z siecią kolagenową. Ponadto lamininy łączą się z integrynami hemidesmosomów.
Entaktyny, zwanej także nidogenem. Białko to łączy sieci kolagenową i lamininową oraz pomaga włączać inne składniki w strukturę ECM
Perlekanu - dużego wielodomenowego proteoglikanu, który wiąże się z wieloma składnikami ECM oraz powierzchni komórek i sieciuje wszystko i trzyma w kupie (w sensie, że razem, nie w kale)
Druga strona blaszki podstawnej zakotwiczona jest wystającymi włóknami kolagenu w bogatej w proteoglikany (a więc gęstej i lepkiej) macierzy tkanki łącznej.

161. Fibronektyna
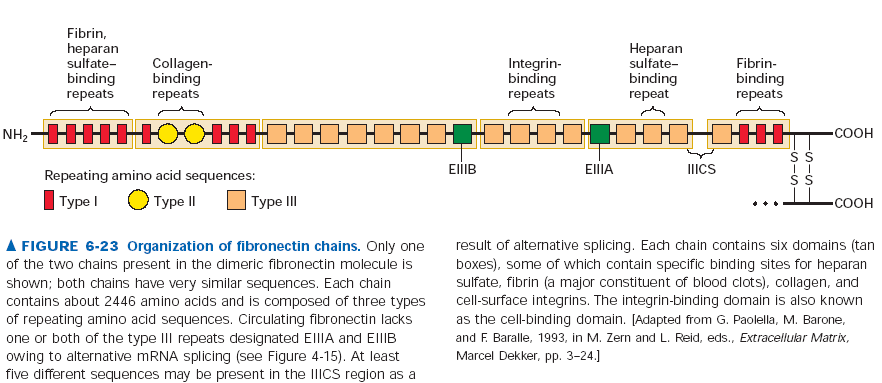
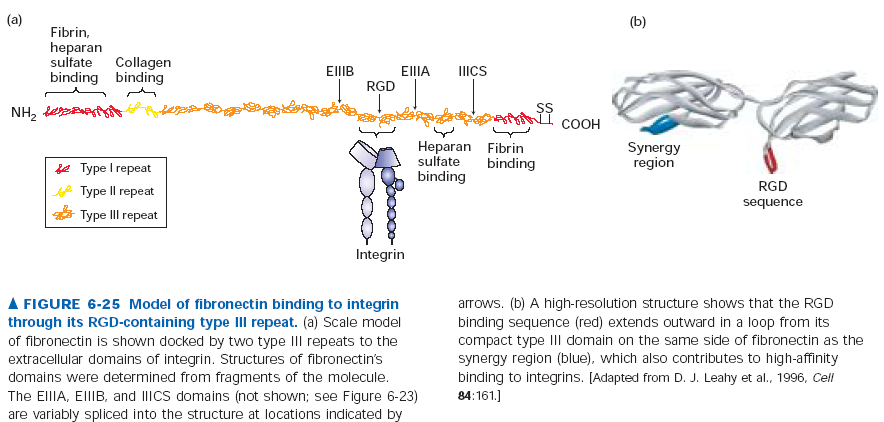
Fibronektyna to powszechnie występujące u wszystkich kręgowców białko multiadhezyjne. Występuje ok 20 jego izoform powstałych na skutek alternatywnego splicingu. Fibronektyna pomaga komórkom wiązać się z ECM, ponieważ wiąże zarówno składniki ECM (włókna kolagenowe i proteoglikany z siarczanem heparanu) jak i integryny na powierzchni komórek. W ten sposób fibronektyna może modulować cytoszkielet i kształt komórek, ale komórki mają też wpływ na ECM. Zaobserwowano, że przy adhezji do ECM z fibronektyną w komórkach następują ruchy integryn związanych z mikrofilamentami. Integryny ciągną cząsteczki fibronektyny, które asocjują w grubsze fibryle, z czasem tworząc stabilne, kowalencyjne połączenia. W ten sposób komórki umacniają swoja pozycję w ECM.
Cząsteczka fibronektyny składa się z dwóch podobnych łańcuchów polipeptydowych (długich na 60nm, grubych na 2-3nm) połączonych dwoma mostkami disiarczkowymi na C-końcach. Każdy taki polipeptyd składa się z 6 domen które zwierają powtórzenia fibronektynowe typu I, II i III. Różne kombinacje takich powtórzeń dają rożną specyficzność fibronektyn. Powtórzenia typu III wiążą integryny i zawierają specyficzne wobec niej sekwencje RGD.
162. Laminina
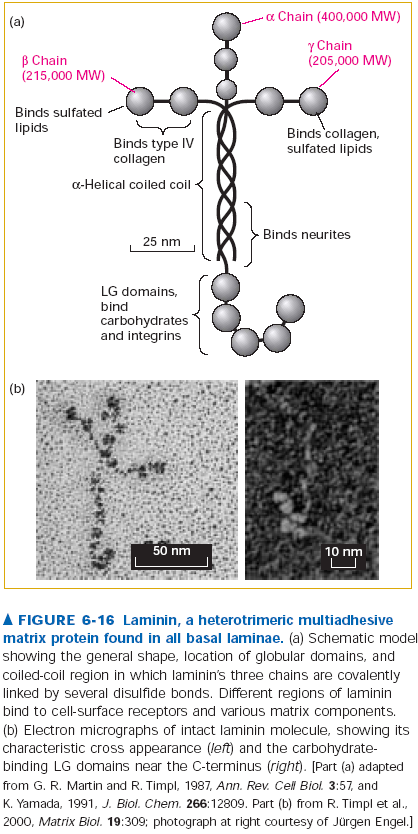
Laminina to główne białko multiadhezyjne blaszki podstawnej. To długie i elastyczne białko wiąże i sieciuje pozostałe składniki blaszki oraz integryny na powierzchni komórek. Laminina jest timerem w kształcie krzyża (masa 820kDa), a podjednostki nawijaj się na siebie w centralnej części tworząc coiled-coil. Ramiona krzyża to domeny wiążące różne składniki ECM. Domeny LG na C-końcu łańcucha alfa łączą się z integrynami i różnymi glikanami przyczepionymi do białek membran komórkowych.
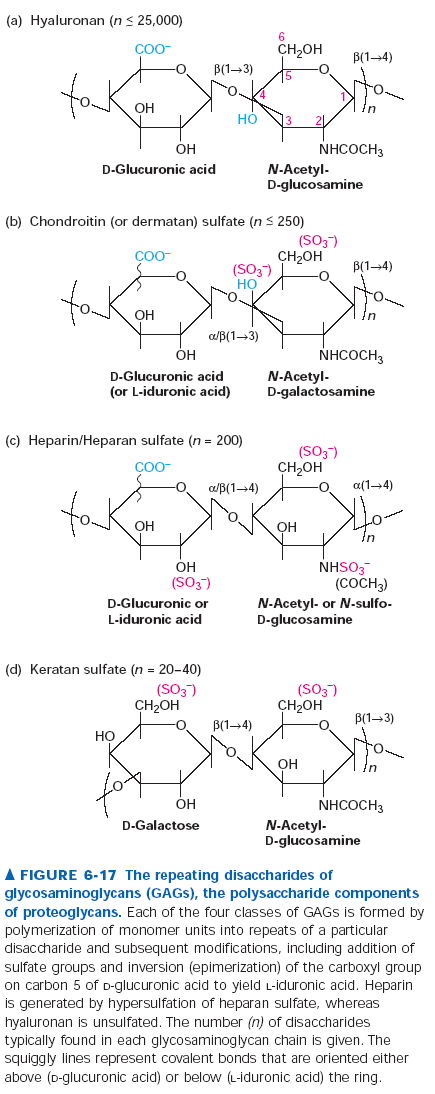
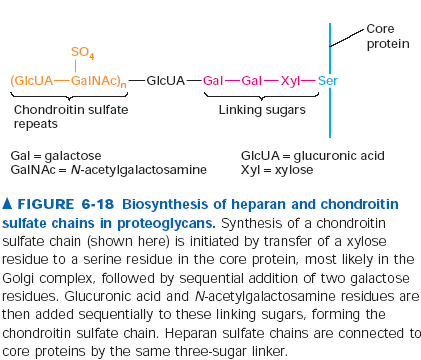
163. Glikozaminoglikany.
Glikozaminoglikany to długie cukrowe łańcuchy dołączone do proteoglikanów, składające się z wielokrotnie powtórzonych dwucukrów. Jeden z cukrów w dwucukrze to zwykle kwas uronowy (G-glukuronowy albo L-iduronowy) a drugi to N-acetyloglukozoamina albo N-acetylogalaktozoamina. Jeden lub oba z nich posiadają dodatkowo grupę sulfonowa albo karboksylową, a więc cały proteoglikan ma spory ładunek ujemny. Ze względu na rodzaj powtarzającego się dwucukry wydziela się: sulfoniany heparanu, chondroityny, dermatanu, keratanu i hialuronian. Wszystkie z wyjątkiem hialuronianu są naturalnymi łańcuchami proteoglikanów dołączonymi wiązanie O lub N glikozydowym. Hialuronian występuje w macierzy tkanki łącznej i agreguje na sobie wiele proteoglikanów tworząc lepkie i absorbujące stresy mechaniczne agregany.
Proteoglikany są tak różnorodną grupą, że ciężko określić ładunki czy masy poszczególnych typów, bo mogą się różnic z cząstki na cząstkę.
Proteoglikany mogą także być glikoproteinami błonowymi.
Mają wiele różnorodnych zadań. Łączą i sieciują różne elementy ECM, zapewniają amortyzacje drgań, uderzeń i zgniatania w ECM, a także pomagają w adhezji komórek do ECM. Proteoglikany błonowe połączone są ze szkieletem aktynowym i mogą brać udział w przekazywaniu sygnałów do komórek. Zaangażowane są na przykład w regulację głodu i sytości w mózgu. Hiper sulfonowany heparan, czyli heparyna, ma zdolność przeciwdziałaniu krzepnięcia krwi i wykorzystuje się go jako lek przeciwzakrzepowy.
164. Połączenia zwarte
Połączenia zwarte - ang. tight junctions to wyjątkowo mocne i szczelne połączenia między komórkami nabłonka. Występują w wiązkach dookoła strony lateralnej komórek nabłonka tak, że praktycznie uniemożliwiają dyfuzję i przepływ płynu okołokomorkowego pomiędzy komórkami nabłonka. Powoduje to, że nabłonek jest szczelną powłoką dla narządów. Jest to szczególnie ważne np. w jelicie, które może mieć kontakt z substancjami toksycznymi.
Połączenia zwarte tworzą okalające komórkę pierścienie okludyn, klaudyn i białek JAM (te ostatnie z superrodziny IgGlobulin). Łączą się one z odpowiednimi rządkami w sąsiednich komórkach przez domeny zewnątrzkomórkowe, a wiązania te choć pojedynczo dość słabe, są tak liczne, że wystarczą do ciasnego spięcia błon komórkowych w miejscu połączenia. Między strona apikalną a bazolateralną występuje kilka rzędów połączeń zwartych co dodatkowo zwiększa szczelność.
Obrazki były przy cząsteczkach białkowych związanych z adhezja komórkową.
Wyszukiwarka
Podobne podstrony:
JW 153 159 adhezja1
159 Present Perfect
164 ROZ M G w sprawie prowadzeniea prac z materiałami wybu
12 151 159 Practical Tests of Coated Hot Forging Dies
164
PaVeiTekstB 164
jw pomal 2005
28jfmt 159 162
Mazowieckie Studia Humanistyczne r1996 t2 n2 s149 159
C G Jung Podstawy psychologii analitycznej str 102 125, 162 164(2)
159
164
JW Energetyka Starosta 1 rok, Regulamin laboratorium Metrologii
153 159
159 ROZ rodzaje dokumentow j Nieznany (2)
ALFA 159 2005pl
elastycznosci JW
więcej podobnych podstron