UKŁAD LIMFATYCZNY
Romuald Wojnicz
Początek rozwoju układu chłonnego datuje się na 5 tydzień życia płodowego. W tym okresie z mezenchymy tworzą się naczynia chłonne oraz powstaje sześć worków chłonnych. Naczynia odchodzące od worków chłonnych przebiegają analogicznie do przebiegu dużych żył.
Grasica rozwija się jako pierwszy narząd limfatyczny. W przeciwieństwie do innych narządów limfatycznych, które powstają z mezodermy, grasica rozwija się zarówno z mezodermy jak i endodermy. Grasica pochodzi z endodermy z małym udziałem ektodermy z brzusznych zachyłków trzecich kieszonek skrzelowych, z których wytwarza się nabłonek endodermalny stanowiący zrąb narządu. W trakcie życia płodowego grasica jest zasiedlana przez komórki omnipotencjalne komórki macierzyste pochodzące ze szpiku, które w grasicy w wyniku podziałów i dojrzewania przekształcają się w immunokompetentne limfocyty T.
Pierwsze węzły chłonne powstają w 3 miesiącu życia płodowego. Z mezenchymy tworzy się torebka i zrąb węzła chłonnego. W późniejszym okresie węzły te są zasiedlane limfocytami wywodzącymi się z komórek macierzystych szpiku.
Zawiązek śledziony pojawia się w już w piątym tygodniu rozwoju płodowego. Zawiązek ten stanowi skupisko komórek mezenchymalnych, które znajduje się między blaszkami krezki grzbietowej żołądka. Komórki te proliferując tworzą zrąb zarówno torebkę jak i zrąb siateczkowy narządu. Limfocyty wnikają do narządu w końcowym okresie życia płodowego.
OGÓLNA HISTOFIZJOLOGIA UKŁADU LIMFATYCZNEGO
Układ limfatyczny (chłonny) zwany także układem immunologicznym jest zbiorem ściśle ze sobą połączonych systemów odpornościowych, które umożliwiają organizmowi zwalczanie infekcji, obronę przed antygenami w tym także komórkami nowotworowymi. Antygeny są substancjami mające następujące właściwości:
Immunogenność, czyli zdolność wywoływania przeciw sobie swoistej odpowiedzi immunologicznej.
Antygenowość, czyli zdolność swoistego łączenia się z immunoglobulinami i receptorami limfocytów T. Antygeny mające tylko tę drugą właściwość nazywamy haptenami. Immunogenność uzyskuje on dopiero po połączeniu z nośnikiem, najczęściej cząstką białka.
Układ limfatyczny składa się z:
Centralnych narządów limfatycznych odgrywających zasadniczą rolę w czynnościowym dojrzewaniu limfocytów
Grasica
Szpik kostny
Obwodowych narządów limfatycznych
Śledziona
Węzły limfatyczne
Migdałki
Tkanka limfoidalna składająca się z limfocytów i komórek prezentujących antygeny płuc (ang.:bronchial-associated lymphoid tissue /BALT/) i błony śluzowej przewodu pokarmowego (ang.:gut-associated lymphoid tissue/GALT)
Naczyń limfatycznych i limfy.
W skład naczyniowego układu limfatycznego wchodzą:
Naczynia limfatyczne włosowate
Naczynia limfatyczne małego i średniego kalibru
Przewody limfatyczne
W skład układu odpornościowego (immunologicznego) wchodzą dwa mechanizmy odporności obejmujące (Tabela 1):
Nieswoisty (wrodzony) układ immunologiczny i związane z nim mechanizmy odporności nieswoistej (ang.:nonspecific or innate immune system). Ochrona powierzchniowa oraz odporność immunologiczna nieswoista stanowią pierwszą linię obrony przeciwko patogenom. W jej skład wchodzą mechanizmy obrony powierzchniowej z kwaśnym środowiskiem skóry oraz substancje immunologicznie aktywne w płynach ustrojowych (lizozym, interferon, układ dopełniacza i inne). Drugim składnikiem układu nieswoistego są komórki dodatkowe układu immunologicznego (makrofagi, granulocyty, komórki NK).
Swoisty (nabyty) układ immunologiczny (ang.:specific or adaptive immune system). Jeśli układ nieswoisty zawiedzie, dochodzi do aktywacji układu swoistego w następstwie kontaktu komórek głównych układu immunologicznego (komórki prezentujące antygen oraz limfocyty) z patogenem. W konsekwencji rozwija się reakcja immunologiczna ukierunkowana na określony typ antygenu. W następstwie tej reakcji powstaje także pamięć immunologiczna (potrz niżej). Mechanizmy odporności swoistej umożliwiają precyzyjną reakcję przeciw określonemu antygenowi. Odporność swoistą zapewniają limfocyty B i T. Należy pamiętać, iż na każdym etapie odpowiedzi immunologicznej oba typy odporności ściśle ze sobą współdziałają.
Ze swoistym układem immunologicznym związane są dwa typy odpowiedzi immunologicznej (Tabela 2) a mianowicie:
Odpowiedź immunologiczna humoralna (bierna) (ang.:humoral immune response or passive immunity) oparta jest o produkcję przez komórki plazmatyczne przeciwciał skierowanych przeciw odpowiednim antygenom (patogenom). Komórka plazmatyczna produkuje tylko jeden typ przeciwciał o wysokim powinowactwie skierowanym przeciwko określonemu antygenowi.
Odpowiedź immunologiczna komórkowa (ang.:cellular immunity or cell-mediated immunity). Odpowiedź ta wymaga uprzedniego związania się antygenu z komórką prezentującą antygen (komórka dendrytyczna, makrofag). Kluczową rolę w komórkowej odpowiedzi immunologicznej odgrywają limfocyty T oraz wymienione powyżej komórki prezentujące antygen.
KOMÓRKI GŁÓWNE UKŁADU LIMFATYCZNEGO
LIMFOCYTY
Najważniejszymi komórkami układu limfatycznego są limfocyty T i B oraz komórki prezentujące antygen (komórki dendrytyczne, makrofagi) (Tabela 3). Po opuszczeniu centralnych narządów limfatycznych (z grasicy limfocyty T natomiast ze szpiku limfocyty B) limfocyty gromadzą się głównie w odpowiednich obszarach obwodowych narządów limfatycznych:
Limfocyty T, w obszarach grasiczozależnych (pas przykorowy węzła chłonnego)
Limfocyty B, w obszarach grasiczoniezależnych (grudki limfatyczne węzła chłonnego)
Wygląd limfocytów T zależy od ich aktywności. Wyróżniamy w krwi obwodowej limfocyty małe, stanowiące do 90% wszystkich limfocytów T. Cechują się one małym jądrem ze zbitą chromatyną oraz słabo widocznym rąbkiem cytoplazmy. Limfocyty te cyrkulują pomiędzy narządami limfatycznymi a krążeniem systemowym. Drugi typ limfocytów (obejmujący 10-30% populacji limfocytów) nazywamy limfocytami dużymi (aktywnymi), które posiadają duże, pofałdowane jądro z obecnością jąderka (wykładnik aktywności transkrypcyjnej genów). Limfocyty te trafiają do krążenia systemowego z tkanek po kontakcie a różnymi antygenami. Pobudzone limfocyty T można wykazać w tkankach stosując przeciwciała monoklonalne skierowane przeciwko antygenowi (markerowi) powierzchniowemu CD38. Antygen ten należy do kilkuset innych markerów powierzchniowych wchodzących w skład międzynarodowego systemu klasyfikacyjnego pozwalającego na wykazanie obecności na powierzchni komórek różnych antygenów zgrupowanych w systemie CD (ang.:claster of differentiation (CD) molecules). Markery CD przyczyniają się do wzajemnej interakcji i przylegania komórek z następową aktywacją limfocytów T. Limfocyty T wykazują obecność antygenów CD2, CD3, CD7 oraz receptorów dla limfocytów T (ang.:T-cell receptors, TCRs). Receptorów TCR będących glikoproteinami i występujących w konfiguracji α i β jest około 20 tysięcy.
Pod względem obecności na powierzchni plazmalemmy receptorów CD4 i CD8 limfocyty T możemy podzielić na 3 grupy:
Limfocyty pomocnicze CD4+ (ang.:helper CD4+ lymphocytes). Komórki te w zależności od wydzielanych przez nie cytokin dzielą się jeszcze na:
Limfocyty pomocnicze Th1 (ang.:type 1 helper T cells). Komórki te charakteryzują się wytwarzaniem cytokin prozapalnych (IFN-γ, IL-2, TNF-β). Cytokiny te stymulują fagocytozę i reakcje cytotoksyczne prowadzone przez makrofagi. Limfocyty te cechuje obecność markera powierzchniowego CD26.
Limfocyty pomocnicze Th2 (ang.:type 2 helper T cells). Limfocyty te produkują inny zestaw cytokin wśród nich: IL-4, IL-5, IL-9, IL-10. Pierwsza z nich stymuluje produkcję przeciwciał skierowanych przeciw pasożytom zewnątrzkomórkowym, druga natomiast nasila odpowiedz immunologiczną ze strony eozynofili. Uważa się, iż limfocyty Th2 uczestniczą głównie w reakcja alergicznych. Limfocyty te wykazują obecność markera powierzchniowego CD30
Limfocyty cytotoksyczne CD8+ (ang.:cytotoxic CD8 lymphocytes). Ich rolą jest eliminowanie innych komórek odbieranych przez organizm jako obce (komórki zainfekowane, komórki nowotworowe, komórki transplantowane)
Limfocyty T gamma/delta, nie posiadają na swojej powierzchni ani antygenów CD4 ani CD8. Komórki te migrują z grasicy do naskórka, błony śluzowej jamy ustnej, jelit czy pochwy, stanowiąc tam pierwszą linię obrony immunologicznej. Mają one charakter komórek stacjonarnych, nieprzemieszczających się do naczyń krwionośnych i limfatycznych.
Limfocyty B różnią się od limfocytów T zarówno miejscem dojrzewania jak i funkcją. Są one miejscem syntezy i wydzielania przeciwciał zwanych immunoglobulinami (Ig), które odpowiadają za odporność typu humoralnego (Tabela 4). Limfocyty B obok komórek dendrytycznych są głównymi komórkami prezentującymi antygen (ang.:antigen-presenting cells). Komórki te dojrzewają w szpiku podlegając mechanizmowi negatywnej selekcji. Dojrzałe limfocyty B uzyskują immunoglobulinę IgM oraz IgD na ich powierzchni. Obie te immunoglobuliny związane są z dwoma innymi immunoglobulinami błonowymi: Igα oraz Igβ tworzą kompleks receptorowy limfocytów B. W odróżnieniu od limfocytów T, limfocyty B rozpoznają antygeny niezwiązane z układem MHC.
KOMÓRKI NK (ang.:natural killer lymphocytes (NK) cells)
Komórki te wywodzą się ze wspólnej komórki macierzystej dla limfocytów B i T, ale nie są ani limfocytami T ani B (nie zawierają receptorów T). Stanowią one 5 do 10% całkowitej populacji krążących limfocytów. Dojrzałe komórki NK po czasowym krążeniu we krwi osiedlają się w różnych narządach. Relatywnie dużo komórek NK jest w wątrobie gdzie stanowią 50% populacji limfocytów. Są to komórki mające zdolność do bezpośredniej cytotoksyczności w stosunku do pewnych transformowanych komórek (komórki zainfekowane, komórki nowotworowe). Komórki NK nie dojrzewają w grasicy i nie wymagają do swojej aktywacji dodatkowych czynników takich jak cytokiny. Mechanizm cytotoksycznego oddziaływania na komórki jest podobny do działania limfocytów cytotoksycznych T. Po rozpoznaniu komórki docelowej komórki NK wydzielają perforyny, glikoproteiny (ang.:pore-forming proteins called perforins) oraz enzymy proteolityczne granzymy (ang.:granule-associated enzymes). Te pierwsze po związaniu z błoną komórki docelowej tworzą kanały błonowe, przez które przenikają wydzielane granzymy. W konsekwencji doprowadza to do lizy komórki. Markerami specyficznymi dla komórek NK są głównie antygeny CD16, CD56 oraz CD94.
KOMÓRKI POMOCNICZE UKŁADU LIMFATYCZNEGO
MAKROFAGI
Makrofagi wywodzą się z monocytów, które przeszły z krwi obwodowej do tkanek. W zależności od tkanki przyjmują one różną nazwę. W wątrobie noszą nazwę komórek Browicza-Kupffera, w kościach osteoklastów a w centralnym układzie nerwowym noszą nazwę komórek mikrogleju. Makrofagi migrują do obszarów zapalenia przyciągane między innymi przez białko C5a układu dopełniacza. Makrofagi są komórkami fagocytarnymi z dużą ilością lizosomów i fagosomów. Do podstawowych immunologicznych funkcji makrofagów należą:
Prezentacja antygenów limfocytom T w węzłach chłonnych lub śledzionie
Produkcja i wydzielanie cytokin, w szczególności IL-1 oraz TNF-α.
W odróżnieniu od komórek dendrytycznych i limfocytów B, makrofagi nie mają pierwotnie cząstek MHC klasy II. Syntetyzują je „de novo” dopiero w wyniku stymulacji INF-γ.
KOMÓRKI DENDRYTYCZNE
Komórki te charakteryzują się obecnością długich wypustek cytoplazmatycznych będących w stałym ruchu, obecnością dużych stężeń antygenów MHC klasy I i II oraz obecnością znacznej liczby markerów powierzchniowych w tym CD1a oraz CD40. Komórki dendrytyczne są pochodzenia szpikowego. Po osiedleniu się w tkankach wychwytują obce antygeny a następnie drogą naczyń limfatycznych dostarczają te antygeny do węzłów lub drogą naczyń krwionośnych do śledziony celem ich prezentacji pomocniczym limfocytom T. Komórki dendrytyczne ze względu na funkcję podzielić można na:
Komórki dendrytyczne niedojrzałe (ang.:immature dendritic cells). Są one obecne w narządach nielimfatycznych (skóra, błony śluzowe) gdzie pełnią funkcję wartowniczą polegającą na wychwycie i transporcie antygenów do węzłów chłonnych lub śledziony. Komórki dendrytyczne niedojrzałe cechują się zdolnością fagocytarną związaną z obecnością na ich powierzchni receptorów dla Fc immunoglobulin oraz receptorów mannozowych.
Komórki dendrytyczne dojrzałe (ang.:mature dendritic cells). Komórki te, osiadłe w narządach limfatycznych tracą zdolności fagocytarne. Ponadto tracą one receptory Fc (receptory dla immunoglobulin) oraz mannozowe, natomiast zyskują silna ekspresję cząstek zaangażowanych w aktywację limfocytów T takich jak: B7, ICAM-1, czy IL-12. Główną funkcją dojrzałych komórek dendrytycznych staje się prezentacja antygenów niepobudzonym limfocytom T (ang.:naive T cells), które przekształcają się w komórki efektorowe (ang.:effector T cells).
Inny podział dzieli komórki dendrytyczne na:
Komórki dendrytyczne mieloidalne, które mogą się różnicować pod wpływem czynnika CM-CSF (ang.:granulocyte-macrophage colony stimulating factor) oraz interleukiny 4 wydzielanej przez monocyty. Wydzielają one duże ilości interleukiny 12 i preferencyjnie indukują aktywację limfocytów pomocniczych Th1.
Komórki dendrytyczne limfoidalne indukujące limfocyty pomocnicze Th2.
PREZENTACJA ANTYGENÓW LIMFOCYTOM T Z UDZIAŁEM ANTYGENÓW ZGODNOŚCI TKANKOWEJ (MHC).
Główny układ antygenów zgodności tkankowej (ang.:major histocompatibility complex, MHC, u ludzi human leukocyte antigens; HLA) składa się z różniących się osobniczo glikoprotein stanowiących składnik błon komórkowych. W skład tego układu wchodzą cząstki MHC klasy I, występujące na powierzchni wszystkich komórek jądrzastych oraz płytek krwi a także cząstki MHC klasy II, obecne na komórkach układu immunologicznego, przede wszystkim limfocytach B, makrofagach oraz komórkach dendrytycznych.
Limfocyty T w odróżnieniu od limfocytów B nie odpowiadają na antygeny rozpuszczalne, lecz antygeny związane uprzednio z cząstkami błonowymi układu zgodności tkankowej MHC. Limfocyty rozpoznają ponadto liniowe determinanty antygenów białkowych (odpowiednie ciągi aminokwasów) w odróżnieniu od przeciwciał, które rozpoznają strukturę trzeciorzędową białek antygenowych. Cząstki MHC mogą prezentować limfocytom T zarówno antygeny natywne (niezmienione) jak i antygeny przygotowane (poddane fragmentacji) przez odpowiednie proteazy komórki prezentujacej antygeny. W prezentacji za pośrednictwem antygenów MHC klasy I uczestniczą wszystkie jądrzaste komórki zawierające te cząstki na swojej powierzchni. W przypadku zainfekowania danej komórki antygeny te ulegają pobudzeniu (modyfikacji), które zostaje rozpoznane przez limfocyty T i tą drogą zostają uruchomione mechanizmy eliminacji tej komórki. W przypadku prezentacji za pośrednictwem klasy II układu MHC, antygeny muszą być najpierw wchłonięte (endocytoza antygenów), „pocięte” przez proteazy a następnie po związaniu w cytoplaźmie z antygenami Klasy II przeniesione drogą egzocytozy na powierzchnię komórki prezentującej. Tam też są rozpoznawane przez limfocyty T.
Prezentacja antygenów w połączeniu z cząstkami MHC klasy I prowadzi do rozpoznania tych antygenów przez limfocyty cytotoksyczne T (CD8+) które następnie niszczą te antygeny (komórki). Prezentacja antygenów za pośrednictwem klasy II MHC jest charakterystyczna dla klasycznych komórek prezentujących antygeny i prowadzi do ich prezentowania limfocytom pomocniczym T (CD4) (Ryc. 1).
AKTYWACJA LIMFOCYTÓW B
Makrofagi, po sfagocytowaniu i przetworzeniu antygenu prezentują go za pośrednictwem cząstek MHC klasy II limfocytom pomocniczym T (CD4+). W następstwie pobudzenia, limfocyty te wchodzą w cykl mitoz (ang.: clonal expansion). W kolejnym etapie limfocyty pomocnicze T wchodzą w bezpośrednią interakcję z limfocytami B powodując ich aktywację, która wzmacniana jest także uwalnianymi przez limfocyty pomocnicze T interleukinami (IL-2, IL-4, IL-5, IL-10, IL-13). W następstwie aktywacji limfocyty B wchodzą w cykl mitotyczny. W rezultacie tworzą się trzy linie pochodne: a/ limfocyty ze specyficznymi przeciwciałami powierzchniowymi służącymi do wiązania antygenów rozpuszczalnych; b/ limfocyty B pamięci immunologicznej, oraz c/ komórki plazmatyczne, będące wysoko zróżnicowanymi limfocytami B produkującymi przeciwciała skierowane przeciw określonemu antygenowi (Ryc. 2).
REAKCJA CYTOTOKSYCZNOŚCI KOMÓRKOWEJ
Wyróżniamy dwa mechanizmy cytotoksycznego oddziaływania komórek układu immunologicznego na komórki efektorowe:
Zależną od przeciwciał cytotoksyczność (ang.:antibody-dependent cell-mediated cytotoxicity). Ten typ cytotoksyczności związany jest z obecnością na powierzchni błony komórkowej komórek NK, makrofagów, neutrofili oraz eozynofili receptorów dla Fc przeciwciał. W przypadku opłaszczenia przeciwciałami komórki zainfekowanej (obcej) komórki posiadające receptor dla Fc indukują reakcje apoptozy lub lizy komórki. Przykładem może być reakcja eliminowania opłaszczonych przeciwciałami komórek nowotworowych.
Niezależną od przeciwciał cytotoksyczność. W przypadku reakcji receptorów limfocytów cytotoksycznych T z antygenem związanym za pośrednictwem układu MHC klasy I dochodzi do bezpośredniego efektu cytotoksycznego (ang.:cell-mediated cytotoxicity). Do uszkadzania komórek dochodzi poprzez oddziaływanie perforyn oraz granzymów z błoną komórkową komórek docelowych. Przykładem może być eliminowanie zainfekowanych wirusem komórek przez limfocyty cytotoksyczne T.
PAMIĘĆ IMMUNOLOGICZNA
Pamięć immunologiczna polega na zdolności organizmu do przyśpieszonej i efektywniejszej reakcji immunologicznej na ponowne wniknięcie do organizmu antygenu. U jej podłoża leży szereg zjawisk. Jednym z nich jest wytworzenie w wyniku pierwszego kontaktu z danym antygenem grupy komórek zwanych klonami, które nie zostaną objęte procesem apoptozy czyli programowanej śmierci komórki. Należy tutaj nadmienić, iż większość aktywowanych limfocytów (ponad 90%) po wygaszeniu procesu zapalnego w organizmie podlega naturalnemu zjawisku ich eliminowania drogą apoptozy. Pozostała część limfocytów stanowi właśnie populację gotową nawet po wielu latach odpowiedzieć wybiórczo na ten sam antygen. Tworzenie się komórek pamięci jest podstawą szczepień.
CENTRALNE NARZĄDY LIMFATYCZNE
GRASICA
Narząd ten jest zlokalizowany w górnym, przednim śródpiersiu. Grasica jest otoczona cienką torebką łącznotkankową, pod którą znajdują się częściowo od siebie oddzielone zraziki stąd nazwa budowa pseudozrazikowa. Ta część grasicy nosi nazwę części zewnętrznej lub kory grasicy natomiast wspólna dla całego narządu część wewnętrzna nosi nazwę pnia grasicy lub rdzenia grasicy. Od kory odchodzą do wnętrza narządu odnogi tkanki łącznej zwane beleczkami, które wytyczają granice zrazika. Zarówno kora jak i beleczki zawierają naczynia krwionośne, efferentne naczynia limfatyczne oraz nerwy. Grasica jest miejscem gdzie niedojrzałe limfocyty T pochodzące ze szpiku kostnego przekształcają się w komórki dojrzałe (także pod względem tolerancji na własne antygeny). Jest ona także narządem dokrewnym wytwarzającym hormony regulujące dojrzewanie i różnicowanie limfocytów zarówno w grasicy jak i narządach obwodowych.
Zrąb grasicy w odróżnieniu od pozostałych narządów limfatycznych nie zawiera tkanki łącznej siateczkowatej. W aspekcie histologicznym grasica jest zbudowana z komórek nabłonkowych (ang.:epithelioreticular cells) pochodzenia entodermalnego, rozciągniętych na kształt sieci a w oczkach tej sieci znajdują się limfocyty T zwane również tymocytami (ang.:thymocytes) Z tego powodu grasica jest traktowana jako narząd limfatyczno-nabłonkowy.. Wskaźnik mitotyczny tymocytów jest bardzo wysoki, co świadczy o intensywnej proliferacji tych komórek. Cechą charakterystyczną dla grasicy jest zjawisko inwolucji tj. stopniowe z wiekiem przekształcanie się grasicy w ciało tłuszczowe zamostkowe. Zjawisko inwolucji zaczyna się po roku od urodzenia i polega na gromadzeniu się w narządzie tkanki tłuszczowej i obniżania się zawartości limfocytów. Wzrasta z wiekiem grasicy także wielkość i ilość ciałek grasiczych (patrz niżej). Mimo inwolucji, skupiska komórek nabłonkowych pozostają i produkują hormony grasicze do końca życia
Zraziki kory grasicy składają się ze słabo barwiących się komórek nabłonkowych zrębu, pomiędzy którymi znajdują się liczne tymocyty. Ich obecność powoduje, iż cały zrazik barwi się silnie zasadochłonnie. Zrąb nabłonkowy zrazików odróżnia grasicę od innych narządów, w których zrąb zbudowany jest z tkanki łącznej siateczkowatej. Komórki nabłonkowe zrębu grasicy (ang.:epithelioreticular cells) ze względu na ścisły kontakt ich wypustek z tymocytami uzyskały nazwę komórek opiekuńczych lub pielęgnujących (ang.:thymic nurse cells). W części korowej komórki te są słabo widoczne w klasycznych barwieniach histochemicznych. Wyliczono, iż komórka opiekuńcza może się kontaktować z około 200 tymocytami. Wyróżnia się co najmniej cztery typy komórek nabłonkowych grasicy (niektórzy autorzy wyróżniają sześć typów komórek) różniących się antygenowo i mających określoną funkcję a mianowicie:
Komórki korowe podtorebkowe, tworzące ciągłą warstwę przechodzącą do wnętrza narządu i pokrywającą przegrody łącznotkankowe i naczynia. Stanowią one barierę oddzielającą różnicujące się limfocyty T od tkanki łącznej torebki, beleczek oraz okołonaczyniowej tkanki łącznej.
Komórki korowe wewnętrzne, charakteryzujące się gwiaździstą budową oraz tworzące sieciowy układ z obszernymi przestrzeniami zawierającymi tymocyty. Tworzą one morfologiczno-czynnościowe przedziały dla różnicujących się limfocytów. Ponadto, są także zaangażowane w sam proces dojrzewania limfocytów. Posiadają, w odróżnieniu od komórek podtorebkowych antygeny obu klas układu HLA (MHC).
Komórki rdzenne, tworzące grubsze struktury przestrzenne zawierające mniej elementów komórkowych. Podobnie jak komórki podkorowe tworzą one funkcjonalną barierę pomiędzy częścią korową a rdzeniem.
Komórki nabłonkowe ciałek Hassala.
Rdzeń grasicy, ze względu na mniejszą zawartość limfocytów T i obecność licznych oraz różnokształtnych komórek nabłonkowych, barwi się słabiej zasadochłonnie w porównaniu do kory. Należy podkreślić, iż część rdzenna jest wspólna dla wszystkich zrazików. Charakterystyczną strukturą części rdzennej są ciałka grasicze zwane ciałkami Hassala. Należy pamiętać, iż nie występują one w korze narządu. Ciałka Hassala pojawiają się już w życiu płodowym. Są to owalne twory zbudowane z komórek nabłonkowych ciałek Hassala które zachodzą na siebie dachówkowato. W komórkach tych wykazano obecność ziaren keratohialiny, pęczków włókien pośrednich oraz kropli lipidowych. Ciałka Hassala podlegają różnym procesom degeneracyjnym. Są naciekane przez limfocyty, makrofagi, eozynofile, mogą formować cysty a także mogą ulegać zwapnieniom. Funkcja ciałek Hassala nie do końca jest wyjaśniona, uważa się produkują one szereg interleukin w tym IL-4 i IL-7, uczestniczących w różnicowaniu i dojrzewaniu limfocytów T.
Na granicy kory i rdzenia grasicy znajduje się rozbudowana sieć naczyń włosowatych. Na wyróżnienie zasługują zawłosowate żyłki mające sześcienny śródbłonek, zbliżony do wysokiego śródbłonka żyłek w węzłach limfatycznych. Rejon ten ponadto obfituje w liczne makrofagi biorące udział w niszczeniu około 95% limfocytów w grasicy. Należy w tym miejscu wspomnieć, iż na granicy kory i rdzenia grasicy znajduje się niewielka populacja limfocytów B, ale ich rola jest nieznana. Cechą charakterystyczną dla grasicy jest brak naczyń limfatycznych doprowadzających.
Do najważniejszych funkcji grasicy należą:
Tworzenie dojrzałych limfocytów T wykazujących tolerancję immunologiczną na własne antygeny z komórek prekursorowych pochodzących ze szpiku
Dostarczanie dojrzałych (immunokompetentnych) limfocytów T do krwioobiegu i tkanek ustroju
Synteza i wydzielanie hormonów i cytokin regulujących dojrzewanie, proliferację i funkcję limfocytów T w grasicy i obwodowych narządach limfatycznych
BARIERA KREW-GRASICA
W przeciwieństwie do obwodowych narządów limfatycznych grasica nie ułatwia, a wręcz utrudnia kontakt limfocytów z antygenami, które dostały się do krwi lub limfy w związku z czym wytworzony został mechanizm określony jako bariera krew-grasica. W jego skład wchodzą:
Ciągły śródbłonek naczyń włosowatych wnikających do narządu od strony torebki. Śródbłonek ten ma grubą podwójną błonę podstawną składającą się z błony podstawnej śródbłonka i komórek nabłonkowych podtorebkowych..
Makrofagi obecne w tkance łącznej okołonaczyniowej naczyń włosowatych. Pełnią one rolę strażników fagocytujących cząstki antygenowe, którym udało się opuścić łożysko naczyniowe.
Komórki korowe podtorebkowe spoczywają na błonie podstawnej otaczając naczynia włosowate. Tworzą one dodatkową barierę izolującą naczynia od otaczającej tkanki.
RÓŻNICOWANIE I DOJRZEWANIE LIMFOCYTÓW T
Proces dojrzewania i różnicowania się niedojrzałych komórek macierzystych dla limfocytów T nosi nazwę edukacji grasiczej (ang.:thymic cell education). Proces ten cechuje się sekwencyjnym uzyskiwaniem lub utratą powierzchniowych antygenów CD w trakcie przesuwania się limfocytów z kory do rdzenia.
Brak obecności receptorów T (TCR), CD4 i CD8 na powierzchni limfocyta wskazuje na wczesną, podwójnie negatywną (ang.:double-negative stage) fazę różnicowania. Ta faza zostaje zastąpiona kolejną fazą, w której na powierzchni limfocytów pojawiają się antygeny CD1. W kolejnej fazie komórki uzyskują 3 antygeny powierzchniowe: TCR, CD4 i CD8. Ta faza dojrzewania nosi nazwę podwójnie dodatniej (ang.:double-positive stage). W tej fazie limfocyty są prezentowane komórkom nabłonkowym. Jeśli limfocyty „prawidłowo” rozpoznają własne antygeny głównego układu zgodności tkankowej (HLA) komórek nabłonkowych przechodzą do dalszej fazy dojrzewania. Jeśli nie, wszystkie one giną w mechanizmie apoptozy czyli programowanej śmierci komórki a pozostałości są usuwane przez makrofagi (95% komórek ginie). Po przejściu do rdzenia komórki tracą jeden z antygenów CD (CD4 lub CD8) stając się komórkami dojrzałymi tj. zawierającymi jeden z tych antygenów (ang.:single-positive stage).
Makrofagi obecne są zarówno w korze jak i rdzeniu natomiast komórki dendrytyczne występują wyłącznie na granicy rdzenia i kory oraz w rdzeniu. Ważne znaczenie dla dojrzewania limfocytów ma fakt, iż komórki zrębu grasicy posiadają w dużym stężeniu antygeny HLA. Po opuszczeniu grasicy limfocyty T zasiedlają obszary grasiczozależne narządów limfatycznych natomiast część krąży w ustroju stanowiąc około 70% wszystkich limfocytów krwi dorosłego człowieka
HORMONY GRASICY
Z grasicy wyizolowano kilkanaście różnych czynników określanych wspólnym mianem hormonów grasicy. Należą do nich między innymi: tymozyna, tymopoetyna, tymulina, tymopentyna, tymostymulina czy grasiczy czynnik humoralny. Wszystkie one są wytwarzane przez komórki nabłonkowe i indukują różnicowanie i dojrzewanie czynnościowe limfocytów T. W grasicy wytwarzane są także inne czynniki układu odpornościowego takie jak: czynniki stymulujące tworzenie kolonii CSF, czynnik martwicy nowotworów TNFα, interleukiny i inne. Najważniejsza dla wewnątrzgrasiczego dojrzewania limfocytów T wydaje się być interleukina 7. Warto wiedzieć, iż w grasicy wytwarzane są także w niewielkich ilościach hormony przysadki: prolaktyna, oksytocyna, wazopresyna.
SZPIK KOSTNY
Szpik kostny (medulla ossium; gr.: myelos; ang. bone marrow), jest drugim obok grasicy centralnym narządem limfatycznym. Występuje w jamach szpikowych kości długich, kościach płaskich czaszki i miednicy. Szpik kostny zbudowany jest z:
Zrębu, w postaci tkanki łącznej właściwej siateczkowatej zawierającej znaczną ilość włókien retikulinowych oraz komórek macierzystych zrębu (ang.:marrow stroma cells). Ponadto w skład zrębu wchodzą komórki macierzyste dla fibroblastów i komórek osteogennych a także makrofagi i komórki tuczne.
Naczyń włosowatych zatokowych. Naczynia te mają budowę pośrednią między włośniczką typu okienkowego a zatokowego. Tutaj ciągły sródbłonek wykazujący aktywność fagocytarną spoczywa na nieciągłej błonie podstawnej. Naczynia zatokowe są szerokie (50-70μm). Na zewnętrznej powierzchni śródbłonka leży nieciągła warstwa komórek siateczki zwanych komórkami przydankowymi które produkują włókna retikulinowe. Komórki te stymulują komórki macierzyste do przejścia w fazę różnicowania się w komórki krwi poprzez wydzielanie szeregu cytokin w tym IL-7
Miąższu szpiku kostnego, który składa się z komórek macierzystych pluripotencjalnych (ang.:pluripotent stem cells) oraz komórek krwi w różnej fazie rozwoju.
Zarówno zrąb jak i układ naczyniowy (nieliczne tętnice, liczniejsze żyły oraz szerokie naczynia zatokowe) tworzą tzw. przedział zrębowy. Jest on utworzony przez komórki tłuszczowe, fibroblasty, komórki zrębbu, śródbłonek naczyniowy, makrofagi oraz naczynia krwionośne. Komórki śródbłonka, fibroblasty szpikowe oraz komórki zrębu produkują hematopoetyczne czynniki wzrostu (ang.:hematopoietic growth factors) oraz cytokiny które regulują tworzenie elementów morfotycznych krwi. Komórki śródbłonka tworzą barierę dla komórek niedojrzałych a jednocześnie umożliwiają jednokierunkową migrację komórką dojrzałym. Komórki tłuszczowe stanowią źródło składników energetycznych jak i syntetyzują czynniki wzrostu. Makrofagi usuwają apoptotyczne komórki oraz jądra erytroblastów. Fagocytują ponadto transferynę (białko nośnikowe dla jonów żelaza) będąc tym samym rezerwuarem jonów żelazowych. Osteoblasty i osteoklasty modelują otoczenie kostne szpiku kostnego. Transport dojrzałych komórek krwi ma charakter transportu transcellularnego zwanego także migracją transendotelialną (patrz: układ naczyniowy).
Drugi przedział zwany przedziałem hemopoetycznym szpiku utworzony jest przez tkankę łączną siateczkowatą oraz wolne komórki układu krwiotwórczego. Obok syntezy składników tkanki łącznej komórki macierzyste zrębu mogą przekształcać się w komórki tłuszczowe regulując tym samym obszar zajęty przez komórki krwiotwórcze. Komórki zrębu tworzą środowisko warunkujące podziały, różnicowanie i dojrzewanie komórek krwi. Zespoły komórek hemopoetycznych układają się w szpiku według określonego schematu. Megakariocyty leżą w bezpośrednim kontakcie z naczyniami zatokowymi podobnie jak komórki szeregu erytroblastycznego. Komórki szeregu granulocytarnego ze względu na posiadaną zdolność ruchu znajdują się dalej od zatok.
Szpik ze względu na budowę histologiczną dzielimy na:
Szpik kostny czerwony, stanowiący miejsce wytwarzania komórek krwi. Składa się z gęstej sieci naczyń krwionośnych i tzw. sznurów hemopoetycznych, które lokalizują się pomiędzy naczyniami.
Szpik kostny żółty, w którym dominuje tkanka tłuszczowa i który utracił zdolność wytwarzania komórek krwi.
W kościach noworodka spotykamy wyłącznie szpik czerwony, natomiast u osób dorosłych szpik czerwony występuje jedynie w nasadach bliższych kości długich, kręgach, żebrach, kościach biodrowych i mostku. Do celów diagnostycznych pobiera się szpik głównie z mostka.
Podsumowując, do funkcji szpiku należą:
Produkcja składników komórkowych krwi
Usuwanie z krążenia zużytych erytrocytów
Różnicowanie limfocytów B
Przechowywanie żelaza związanego z ferrytyną w cytoplazmie makrofagów.
WĘZŁY LIMFATYCZNE
Węzły limfatyczne (chłonne) (noduli lymphatici) są obwodowymi narządami limfatycznymi, leżącymi na przebiegu naczyń limfatycznych, pełniąc tym samym funkcję filtrującą chłonkę. Węzły chłonne są bardzo wydajnym narządem filtracyjnym. Wprowadzenie do naczyń limfatycznych doprowadzających bakterii a następnie ocena ilości bakterii, które opuściły węzeł wykazała, iż 99% bakterii zostało zatrzymanych w węźle. Ta zdolność filtracji ma też negatywne znaczenie. Zatrzymywane w węźle komórki nowotworowe przełamują zwykle reakcje immunologiczne skierowane przeciw nim i często w nim proliferują. Określa się to jako przerzuty nowotworowe do węzłów chłonnych. Ważne jest zatem, aby usunięciu nowotworu towarzyszyło usunięcie okolicznych węzłów chłonnych. Węzły chłonne przyjmują kształt nerkowaty i mierzą od kilku do 20mm. Naczynia chłonne doprowadzające limfę do węzła wchodzą do niego w części wypukłej natomiast wychodzą w części wklęsłej. Do zasadniczych funkcji węzła chłonnego zaliczyć można:
Namnażanie limfocytów B i T
Powstawanie limfocytów aktywowanych określonymi antygenami,
Filtrowanie chłonki i zatrzymywanie antygenów
Produkcję przeciwciał
W węźle limfatycznym wyróżnia się:
Torebkę, zwykle otoczoną tkanka tłuszczową, od której w kierunku rdzenia odchodzą beleczki zbudowane z tkanki łącznej zbitej nieregularnej zwane beleczkami promienistymi.
Korę (kora powierzchniowa), zawierającą grudki chłonne składające się z limfocytów B, komórek plazmatycznych, komórek dendrytycznych oraz makrofagów. Grudki chłonne noszą nazwę strefy grasiczoniezależnej.
Strefa podkorowa (kora głęboka) leżąca poniżej kory zawiera głównie (około 70%) limfocyty pomocnicze T (CD4+). Z tego powodu ta część węzła nosi nazwę strefy grasiczozależnej.
Rdzeń zbudowany ze sznurów tkanki limfoidalnej otaczającej liczne mikronaczynia.
Obok torebki i beleczek promienistych także tkanka łączna siateczkowata tworzy zrąb węzła. W skład tej ostatniej wchodzą wyspecjalizowane fibroblasty zwane komórkami retikularnymi (ang.:fibroblastic reticular cells) ukierunkowanymi na syntezę włókien kolagenowych III typu (retikulina). Komórki te cechują się licznymi i cienkimi wypustkami cytoplazmatycznymi stykającymi się z pęczkami włókien retikulinowych.
W części korowej zlokalizowane są skupiska tkanki limfoidalnej zwane grudkami chłonnymi (folliculi lymphatici; ang.:lymphatic nodules). Wyróżniamy dwa typy grudek a mianowicie grudki chłonne pierwotne, barwiące się jednolicie oraz grudki chłonne wtórne, mające jaśniejszą część środkową zwaną centrum rozmnażania. Grudki są skupiskiem głównie limfocytów B, komórki dendrytyczne grudek (ang.:follicular dendritic cells) oraz pojedyncze makrofagi. W przypadku dotarcia antygenu do węzła drogą krwi lub chłonki (związanego z komórkami prezentującymi antygen lub niezwiązanego) dochodzi do pobudzenia limfocytów CD4+ a następnie limfocytów B grudki. Skutkiem kooperacji: limfocyt B - limfocyt T/CD4+ oraz współdziałania komórek dendrytycznych grudki tworzą się centra rozmnażania. Dochodzi w nich do licznych mitoz zwielokrotniających liczbę pobudzonych limfocytów B. W efekcie ich następowego dojrzewania przekształcają się one w komórki plazmatyczne gotowe do produkcji określonego przeciwciała. Komórki plazmatyczne wywędrowywują z grudek przemieszczając się do sznurów rdzennych.
Część przykorowa będąca strefą grasiczozależną zawiera głównie skupiska limfocytów T tworzących tkankę limfoidalną rozproszoną, komórki dendrytyczne splatające się (ang.:dendritic cells), które pochodzą z narządów nielimfatycznych (komórki Langerhansa) a także liczne postkapilarne żyłki z wysokim śródbłonkiem (sześciennym) (ang.:high endothelial velules). Główną rolą komórek dendrytycznych splatających się w tej części węzła jest prezentowanie antygenu limfocytom T.
Limfocyty z kory i części przykorowej wędrują do rdzenia, który stanowi środkową część węzła. Zarówno limfocyty, jaki i komórki plazmatyczne, makrofagi, oraz fibroblasty układają się w pasma zwane sznurami rdzennymi (ang.:medullary cords). W tej części narządu znajdują się także liczne postkapilarne żyłki z charakterystycznym sześciennym (wysokim) śródbłonkiem. Część rdzenna jest także grasiczozależna.
Naczynia limfatyczne zbiorcze doprowadzające dzięki zastawkom oraz komórkom mięśniowym gładkim ściany naczyń warunkują jednokierunkowy (do węzła) przepływ limfy przez zatoki brzeżne (podtorebkowe) (ang.:subcapsular sinus), promieniste (beleczkowe) (ang.:trabecular sinus) w kierunku zatok rdzenne (ang.:medullary sinus), otoczonych w obrębie rdzenia przez bogatokomórkowe sznury rdzenne. Ściany zatok będące przestrzeniami wypełnionymi luźnym utkaniem tkanki siateczkowatej zbudowane są z ze śródbłonka zatokowego. W obrębie przerw nieciągłej błony podstawnej lokalizują się wypustki komórek prezentujących antygen, makrofagi oraz limfocyty. Ma to duże znaczenie dla oczyszczania limfy np. z bakterii. Zatrzymaniu ulegają także komórki nowotworowe stanowiące element obcy dla organizmu. W związku z obecnością „uszczelnień” w postaci sieci włókien kolagenowych, komórek retikularnych oraz wypustek komórek dendrytycznych naczynia zatokowe chłonne węzła różnią się od zatokowych naczyń krwionośnych. To uszczelnienie umożliwia kontrolę przepływu limfy oraz nasila filtrację chłonki pozbawiając ją różnych patogenów. Naczynia tętnicze wnikają do węzła przez wnękę i po dotarciu do kory rozgałęziają się w sieć naczyń włosowatych, które następnie przechodząc w żyły wraca do wnęki. Naczynia krwionośne pełnią między innymi funkcje recyrkulacji limfocytów.
ŚLEDZIONA
Śledziona (lien; gr.: splen) jest największym, obwodowym narządem limfatycznym o masie 100-200g. Leży na przebiegu naczyń krwionośnych, które w samym narządzie tworzą silnie rozbudowany układ naczyniowy ściśle połączony z komórkami układu limfatycznego stanowiąc zasadniczy element budowy tego narządu. Stąd też określenie śledziony jako narządu krwiolimfatycznego. Śledziona otoczona jest torebką zbudowaną z tkanki łącznej zbitej zawierającej liczne jak na torebkę łącznotkankową komórki mięśniowe gładkie. Torebka nie zawiera natomiast otoczki tłuszczowej. Od torebki w głąb narządu odchodzą krótkie, silnie się rozgałęziające beleczki łącznotkankowe natomiast narząd wypełnia tkanka łączna siateczkowata. Beleczki łącznotkankowe są szczególnie grube i liczne w okolicy wnęki śledziony. Torebka, beleczki oraz tkanka łączna siateczkowata tworzą zrąb narządu. W gęstej sieci włókien siateczkowatych gromadzą się komórki zrębu, makrofagi, komórki dendrytyczne oraz liczne komórki krwi. Należy pamiętać, iż w śledzionie nie ma podziału narządu na korę i rdzeń.
Fragment nieutrwalonej śledziony uwidacznia obszary ciemniejsze i jaśniejsze. Te pierwsze noszą nazwę miazgi czerwonej te drugie miazgi białej. Tradycyjny podział na miazgę czerwoną i białą może być mylący gdyż dotyczy wyglądu miąższu świeżo pobranej śledziony. Po utrwaleniu i zabarwieniu wycinka hematoksyliną i eozyną miazga biała będzie ciemniejsza gdyż zawiera więcej limfocytów (ich jądra barwią się na niebiesko) w porównaniu do miazgi czerwonej obfitującej w krwinki czerwone.
Miazga czerwona (pulpa lienis rubra) przypominająca gąbkę zawiera bogatą sieć naczyń zatokowych (ang.:splenic sinusoid) wypełnionych elementami morfotycznymi krwi w proporcji zbliżonej do występującej w krwi pełnej. Miazga czerwona oprócz wymienionych zatok śledzionowych zawiera ponadto oddzielające je sznury śledzionowe (ang.:splenic cords; cords of Billroth). Składają się one z luźnej sieci włókien siateczkowych tworzących przestrzenie wypełnione wynaczynioną krwią. Włókna siateczkowe otoczone są gwiaździstymi komórkami siateczowymi (ang.:stellate reticular cells) izolującymi je od płytek krwi, co zabezpiecza przed procesem wykrzepiania. Główną funkcją miazgi czerwonej jest usuwanie zmienionych (zużytych) erytrocytów, eliminowanie mikroorganizmów z krążenia oraz utrzymywanie puli erytrocytów. Usuwanie bakterii odbywa się za pośrednictwem makrofagów zarówno w wyniku bezpośredniej fagocytozy jak i po opłaszczeniu patogenu białkami układu dopełniacza oraz immunoglobulinami.
Miazga biała (pulpa lienis alba) jest chłonną częścią śledziony. Miazgę białą tworzą pochewki tętnicy centralnej składające się z limfocytów T oraz przylegające do nich grudki chłonne zawierające ośrodek rozmnażania (w przypadku pobudzenia immunologicznego) oraz strefę brzeżną leżącą na obwodzie pochewki i grudki. Strefa brzeżna (około 0.1mm średnicy) oddziela miazgę białą od miazgi czerwonej. W jej skład wchodzą komórki plazmatyczne, limfocyty B i T, makrofagi oraz komórki dendrytyczne. Obszar ten unaczyniony jest przez włosowate naczynia zatokowe zwane zatokami brzeżnymi (ang.:marginal sinuses) dochodzącymi do miazgi czerwonej.
UNACZYNIENIE ŚLEDZIONY
Ważnym pod względem czynnościowym jest wysoko wyspecjalizowane unaczynienie śledziony. Po wniknięciu do wnęki narządu, tętnica śledzionowa rozgałęzia się na tętnice torebkowe, których odgałęzienia przebiegają w beleczkach śledzionowych nosząc nazwę tętnic beleczkowych. Po opuszczeniu beleczek tętnice przechodzą w tętnice środkowe (centralne) o średnicy około 0.2mm. Ich charakterystyczną cechą jest luźna organizacja przydanki, która zawiera liczne limfocyty T otaczające tętnicę środkową w postaci cylindrycznej pochewki (ang.:periarterial lymphatic sheaths). Często do pochewki przylega grudka chłonna powodując na przekrojach poprzecznych zepchnięcie tętnicy centralnej na obwód. W skład pochewek wchodzą limfocyty T. Tętnica centralna pod koniec przebiegu traci pochewkę i rozgałęzia się na 2 do 6 tętniczek zwanych pędzelkowatymi (ang.:penicillar arterioles), które wchodząc do miazgi czerwonej przechodzą w naczynia włosowate. Tętniczki pędzelkowate w końcowym odcinku tworzą kapilary tętnicze, które otoczone są skupiskami makrofagów (ang.:macrophage-sheathed capillaries). Kapilary tętnicze dostarczają krew do zatok śledzionowych. Są to wyjątkowe w organizmie kapilary, które są ślepo zakończone i nie posiadają komórek śródbłonkowych, których miejsce zastępują skupiska makrofagów. Krew po przejściu przez te naczynia włosowate wchodzi do miazgi czerwonej oraz zlokalizowanej w niej sieci postkapilarnych naczyń zatokowych. Jest to jedyne w organizmie człowieka miejsce gdzie krew w warunkach fizjologicznych znajduje się poza naczyniem krwionośnym.
FUNKCJA IMMUNOLOGICZNA I HEMOPOETYCZNA ŚLEDZIONY
W odróżnieniu od pozostałych, obwodowych narządów limfatycznych limfocyty śledzionowe są pobudzane antygenami, które dotarły drogą naczyń krwionośnych. Śledziona uczestniczy głównie w odpowiedzi immunologicznej typu humoralnego, czyli wytwarzaniu przeciwciał. Specyfika odpowiedzi immunologicznej w śledzionie wynika z pobudzenia immunologicznego występującego pod wpływem niewielkiej ilości antygenów. W warunkach prawidłowych obce antygeny docierają najpierw do tkanek, a następnie z chłonką docierają do węzłów chłonnych gdzie zwykle ulegają eliminacji. Dopiero przełamanie odpowiedzi immunologicznej węzłów powoduje, iż antygeny dostają się do krwi a tą drogą do śledziony. Jak stwierdzono, dotarcie obcych antygenów do śledziony powoduje już od drugiego dnia aktywację limfocytów w miazdze białej. Dzięki kooperacji limfocytów T i komórek dendrytycznych w obrębie grudek chłonnych śledziony dochodzi do pobudzenia limfocytów B, które różnicują się w plazmocyty a następnie przechodzą do miazgi czerwonej uwalniając znaczną ilość immunoglobulin. Rozpuszczalne antygeny eliminowane są dzięki wytwarzanym przeciw nim przeciwciałom. Bakterie podlegają eliminacji po uprzedniej opsonizacji przez makrofagi i leukocyty. Komórki zainfekowane wirusem są eliminowane przez limfocyty cytotoksyczne powstające w pochewkach tętnicy centralnej. Makrofagi eliminują także płytki krwi oraz erytrocyty. Ponieważ stare erytrocyty tracą elastyczność nie są w stanie penetrować przestrzeni śródbłonka zatokowego co staje się sygnałem do ich eliminacji.
Czynność limfopoetyczna śledziony powoduje uwalnianie do krwioobiegu znacznej ilości limfocytów, które opuszczają śledzionę żyłą śledzionową. Tylko niewielka ilość limfocytów opuszcza śledzionę drogą naczyń chłonnych. Warto podkreślić, iż w śledzionie występują jedynie naczynia limfatyczne odprowadzające, które są nieliczne i występują głównie w okolicach wnęki.
Śledziona nie jest niezbędna do życia człowieka. Po jej usunięciu jej funkcję przejmują inne narządy limfatycznie głównie szpik i węzły chłonne. Jednakże zaobserwowano, iż osoby z usuniętą śledziona są bardziej narażone na cięższy przebieg infekcji bakteryjnych.
Funkcja hemopoetyczna śledziony w okresie płodowym polega na wytwarzaniu wszystkich komórkowych składników krwi zarówno szeregu erytrocytarnego jak i limfocytarnego, a także płytek krwi. Ta funkcja śledziony w wieku dojrzałym ogranicza się do wytwarzania limfocytów i monocytów. W przypadku niektórych schorzeń takich jak białaczki, niedokrwistości czy ciężkie schorzenia infekcyjne, miazga czerwona śledziony może ulec tak zwanej metaplazji szpikowej i podjąć płodową aktywność hemopoetyczą. Podsumowując, ww. funkcje śledziony można uszeregować w następujący sposób:
Jest rodzajem filtru, który zatrzymuje i niszczy zużyte elementy morfotyczne krwi
Komórki dendrytyczne śledziony prezentują antygeny limfocytom pomocniczym T
Jest miejscem proliferacji limfocytów
Jest rezerwuarem krwi
W okresie płodowym wytwarza wszystkie elementy morfotyczne krwi
GRUDKI LIMFATYCZNE NIEOTORBIONE
Grudki limfatyczne nieotorbione występują pojedynczo (grudki limfatyczne samotne) lub w skupiskach (grudki limfatyczne skupione) w błonach śluzowych i podśluzowych tworząc tzw. tkankę limfatyczną błony śluzowej (ang.: mucosa-associated lymphatic tissue; MALT). Występuje ona głównie w błonie śluzowej przewodu pokarmowego (ang.: gut-associated lymphoid tissue; GALT), dróg oddechowych (ang.: bronchus-associated lymphoid tissue; BALT), układu moczowo-płciowego oraz gruczołów sutkowych. Koncepcja wspólnego układu odpornościowego dla błon śluzowych powstała w wyniku obserwacji, iż aktywacja limfocytów w jednym obszarze powodowała ogólnoustrojową odporność w błonach śluzowych innych narządów takich jak płuca czy układ moczowo-płciowy.
Obok grudek w obrębie błon śluzowych i podśluzowych występują także pojedyncze limfocyty B, komórki plazmatyczne, limfocyty T oraz komórki NK. W błonie surowiczej pokrywającej jamę otrzewnej i opłucnej występują także skupiska komórek głównie limfocytów i makrofagów. Noszą one nazwę plamek mlecznych. Są one szczególnie dobrze rozwinięte u dzieci zanikając stopniowo u osób dorosłych będąc źródłem makrofagów i limfocytów jamy opłucnowej i otrzewnej.
Szczególną rolę obronna w obrębie tkanki limfatycznej błony śluzowej pełnią komórki Panetha, występujące w dnach gruczołów jelitowych (krypty Liberkühna). Komórki te syntetyzują szereg białek takich jak lizozym, fosfolipazę A2 a także defensyny α. Białka te uwalniane są z komórek Panetha pod wpływem zetknięcia się ich z obcymi patogenami (bakterie).
Podstawową funkcją układu limfatycznego błon śluzowych jest wytwarzanie przez komórki plazmatyczne przeciwciał typu IgA. Immunoglobulina ta po wytworzeniu wiąże się z jej receptorem na wewnętrznej powierzchni enterocyta i trogą endo- oraz transcytozy jest uwalniana w mechanizmie egzocytozy do śluzu jelitowego stanowiąc główny składnik bariery immunologicznej dla patogenów. Innymi składnikami tej bariery są: śluz, kwaśne pH czy naturalna flora bakteryjna.
Ze względu na specyficzną lokalizację i znaczenie w odpowiedzi immunologicznej wśród grudek chłonnych skupionych wyróżniono:
Migdałki
Kępki Peyera w ścianie jelita krętego i grubego
Grudki limfatyczne skupione wyrostka robaczkowego
Cechą wspólna tych trzech skupisk tkanki chłonnej jest występowanie w otaczającym ich nabłonku tzw. komórek M. Komórki te zamiast mikrokosmków mają mikrofałdy pokryte glikokaliksem, stąd też ich nazwa. Drugą ich cechą jest obecność wpukleń błony komórkowej, które tworzą charakterystyczne kieszonki, w których lokalizują się limfocyty T i B (większość to komórki pamięci immunologicznej). Główną funkcją komórek M jest wychwytywanie patogenów i przenoszenie ich w głąb błony śluzowej gdzie w wyniku reakcji z komórkami dendrytycznymi dochodzi do uruchomienia odpowiedzi immunologicznej. Część tych antygenów może być internalizowana przez limfocyty B i prezentowana już w obrębie komórek M limfocytom T.
MIGDAŁKI
Migdałki (tonsillae, ang.: tonsils) stanowią grudki chłonne ułożone pojedynczo lub w skupiskach pod nabłonkiem w miejscu skrzyżowania odcinka dróg oddechowych i przewodu pokarmowego. Miejsce to jest ważne w aspekcie funkcji obronnych układu immunologicznego człowieka. Wyróżnia się przede wszystkim migdałki podniebienne, językowe i gardłowe. Migdałki podniebienne pokryte są nabłonkiem wielowarstwowym płaskim nierogowaciejącym. Nabłonek wnika w głąb tkanki limfatycznej tworząc tzw. krypty. Migdałeki językowe w ilości kilku znajdują się u nasady języka. Nabłonek wielowarstwowy płaski tworzy tutaj jedną kryptę, wzdłuż której układają się grudki chłonne. Migdałek gardłowy stanowi pojedynczą strukturę w tylno-górnej części gardła. Dla odmiany jest on pokryty nabłonkiem wielorzędowym walcowatym migawkowym (podobnie jak ta okolica gardła) oraz tylko częściowo nabłonkiem wielowarstwowym płaskim. Nabłonek ten nie tworzy krypt w odróżnieniu od dwóch pozostałych migdałków. Wśród innych migdałków wyróżnić można migdałki nagłośniowe, trąbkowe oraz krtaniowe.
KĘPKI PEYERA
Tkanka limfatyczna związana ze ścianą jelit stanowi największe skupisko limfocytów w organizmie. Kępki Peyera stanowią grupy grudek limfatycznych występujących w błonie śluzowej i podśluzowej jelita krętego i grubego, w których dominują limfocyty B stanowiąc 80% ich składu komórkowego. U ludzi można je także spotkać w jelicie czczym a nawet w dwunastnicy. Od strony światła jelita grudki są pokryte nabłonkiem jednowarstwowym walcowatym, którzy tworzy charakterystyczny kształt kopuły. W kopułach brak jest typowych komórek nabłonkowych natomiast występują wcześniej opisane komórki M oraz pojedyncze komórki kubkowe. Kępki Peyera stanowią główny obszar indukcji odpowiedzi immunologicznej w błonach śluzowych. Dochodzi w nich do wytwarzania limfoblastów zwanych IgA(+), które są prekursorami plazmocytów obecnych w błonach śluzowych i wytwarzających immunoglobulinę IgA.
GRUDKI LIMFATYCZNE WYROSTEKA ROBACZKOWEGO
Narząd ten zawiera liczne oraz duże grudki limfatyczne leżące na blaszce właściwej błony śluzowej i sięgające głęboko do warstwy podśluzowej. Tkanka limfatyczna wraz z wiekiem ulega zanikowi. Dawniej wyrostek robaczkowy nazywano migdałkiem brzusznym.
NACZYNIOWY UKŁAD LIMFATYCZNY
W skład naczyniowego układu limfatycznego wchodzą:
Naczynia limfatyczne włosowate
Naczynia limfatyczne małego i średniego kalibru
Przewody limfatyczne
W naczyniach limfatycznych płynie limfa, która jest zbierana z tkanek i transportowana do żył. Po drodze naczynia limfatyczne doprowadzają limfę do wielu węzłów chłonnych, w których zatrzymaniu ulegają zawarte w limfie antygeny. Ponadto, w węzłach limfatycznych do limfy przedostają się limfocyty, makrofagi i przeciwciała.
Naczynia limfatyczne włosowate zaczynają się ślepo w tkance łącznej. Są zdecydowanie większe aniżeli naczynia włosowaty (średnica około 100µm). Zarówno sródbłonek jak i błona podstawna naczyń włosowatych limfatycznych ma budowę nieciągłą umożliwiając przenikanie przez ścianę dużych cząstek oraz komórek. Limfatycznych naczyń włosowatych brak w tkance łącznej podporowej, szpiku kostnym, łożysku oraz powierzchownej warstwy błony śluzowej właściwej macicy, co warunkuje tolerancję immunologiczna na rozwijający się zarodek.
Naczynia limfatyczne małego i średniego kalibru są zdecydowanie cieńsze aniżeli analogicznych naczyń żylnych. Naczynia średniego kalibru mają typową trójwarstwową budowę oraz posiadają zastawki, które warunkują jednokierunkowy przepływ limfy.
Przewody limfatyczne powstają w wyniku łączenia się mniejszych naczyń limfatycznych. Wyróżniamy przewód limfatyczny prawy uchodzący do żyły ramienno-głowowej prawej oraz przewód piersiowy, uchodzący do układu żylnego w miejscu połączenia się lewej żyły szyjnej i podobojczykowe.
ASPEKTY KLINICZNE
|
Rozplem nowotworowy tkanki chłonnej (Lymphomas) Zmiany rozplemowe dotyczące limfocytów w obrębie węzłów chłonnych noszą nazwę chłoniaków. Dotyczą one zarówno limfocytów B jak i T. Postać chłoniaka zależy od fazy rozwoju limfocytów oraz ich funkcji. Wśród wielu chłoniaków na uwagę zasługują chłoniaki typu Hodgkina w węzłach chłonnych. Wyróżnia się, co najmniej sześć typów chłoniaków typu Hodgina. Choroba ta cechuje się obecnością rozplemu limfocytów B z obecnością komórek Reed-Sternberga. Komórki te są patognomoniczne dla klasycznej postaci tej choroby. Reprezentują one pojedyncze, duże, wielojądrzaste komórki duże, wywodzącymi się z limfocytów B. Komórki Reed-Sternberga występują w wielu odmianach. Jedną z nich stanowią komórki zatokowe (ang.: lacunar cells) cechujące się charakterystycznym przejaśnieniem wokół komórki oraz jednym jądrem. Komórki Reed-Sternberga mogą być identyfikowane w badaniu immunohistologicznym z wykorzystaniem antygenów CD15 i CD30. |
Rozplem nienowotworowy tkanki chłonnej Przewlekłe reakcje zapalne powodują pojawienie się grudek limfatycznych z ośrodkami rozmnażania w narządach nielimfatycznych. Takie skupiska tkanki limfoidalnej można zaobserwować w tarczycy w przebiegu zapalenia Hashimoto, w maziówce w reumatoidalnym zapaleniu stawów czy w błonie wewnętrznej tętnic objętych miażdżycą. W trakcie zwykle ostrej reakcji zapalnej mogą pojawić się skupiska nacieków komórkowych limfocytarnych. Cecha, która je wyróżnia od grudek limfatycznych jest nieregularny kształt i brak ośrodków rozmnażania |
Punkcja i biopsja szpiku Szpik kostny pobiera się przyżyciowo zarówno w celach diagnostycznych jak i leczniczych. Do pobrania tkanki szpiku kostnego wykorzystuje się dwie metody a mianowicie punkcję aspiracyjną oraz biopsję cienkoigłową. Zwykle miejscem pobrania jest mostek, kość piszczelowa u dzieci i grzebień biodrowy miednicy. Ten ostatni służy do wykonywania biopsji cienkoigłowej. Z aspiratu wykonuje się rozmaz szkiełkowy i barwi metodą Wright lub May-Grunwald-Giemsa. Celem badania aspiracyjnego szpiku jest ocena stadiów hemopoezy. Biopsja cienkoigłowa jest natomiast przydatna w ocenie zarówno elementów komórkowych jak i całego zrębu. Biopsja szpiku umożliwia ocenę liczby komórek hemopoetycznych. Wykonuje się ją metodą półilościową określając stosunek komórek hemopoetycznych do komórek tłuszczowych. Stosunek ten zmienia się wraz z wiekiem. Stosunek ten obliczamy odejmując od 100 wiek chorego ± 10%. I tak u 30-letniego mężczyzny liczba komórek hemopoetycznych wynosi 69-80% (100-30=70±10%), natomiast u 70-letniego mężczyzny tylko 20-30% całkowitej liczby komórek (100-70=30±10%). Szpik prawidłowy nosi nazwę normocellularnego (ang.: normocellular bone marrow). W hypocelullarnym szpiku (ang.: hypocellular bone marrow) są odnajdywane tylko nieliczne komórki hemopoetyczne. Odwrotnie, w szpiku leukemicznym komórkowość może wzrosnąć do 90% (ang.: hypercellular bone marrow). |
Tabela 1. Mechanizmy odporności immunologicznej
Mechanizmy odporności nieswoistej (naturalnej) (ang.: innate [natural] immunity)
|
Mechanizmy odporności swoistej (ang.: adaptive immunity also called acquired or specific immunity)
Limfocyty B Komórki plazmatyczne
Limfocyty T |
Tabela 2. Typy odporności immunologicznej
Odporność immunologiczna bierna (powstaje w wyniku dostarczania do organizmu przeciwciał) Przeciwciała transferowane do płodu drogą łożyska (odporność naturalna) Przeciwciała uzyskiwane drogą immunizacji (surowica odpornościowa np. przeciwtężcowa) odporność sztuczna) Antytoksyny (przeciwciała przeciw toksynom np. błonicy) (odporność sztuczna) |
Odporność immunologiczna czynna (powstaje w wyniku kontaktu organizmu z antygenem). Dzieli się na: Naturalną (przechorowania) Sztuczną (szczepionki). Biorą w niej udział następujące komórki: Limfocyty T Limfocyty B Komórki prezentujące antygen (komórki dendrytyczne) |
Tabela 3. Komórki zaangażowane w reakcje immunologiczne
Typ komórki |
Marker kliniczny |
Główne funkcje |
Limfocyty Limfocyty B Limfocyty T - Pomocnicze - Cytotoksyczne Komórki NK |
CD9, 19, 20 i 24 Antygen CD2 i 3 Antygen CD4 Antygen CD8 Antygen CD94 |
Produkcja przeciwciał, prezentacja antygenu Komórkowe reakcje immunologiczne
Cytotoksyczna odpowiedz immunologiczna |
Komórki pomocnicze (accesory or supporting cells) Makrofagi (Monocyty) Komórki dendrytyczne |
Antygen CD68 Antygen CD1a |
Odporność nieswoista, prezentacja antygenu Prezentacja antygenu |
Komórki efektorowe (effector cells) Makrofagi Limfocyty T cytotoksyczne Neutrofile |
Antygen CD68 Antygen CD8 Antygen CD45 |
Fagocytoza Reakcja cytotoksyczna Fagocytoza |
Tabela 4. Typy immunoglobulin ludzkich
Izotyp |
Stężenie w surowicy w mg/ml |
Udział procentowy we krwi |
Komórki, z którymi wiążą się Ig za pośrednictwem Fc |
Główne funkcje |
IgG |
12 |
85 |
Makrofagi / Limfocyty B / Komórki NK / Neutrofile / Eozynofile |
Ig wtórnej reakcji immunologicznej; aktywuje dopełniacz; |
IgM |
1 |
5-10 |
Limfocyty B |
Ig pierwotnej reakcji immunologicznej; aktywuje makrofagi; służy jako receptor dla limfocytów B. |
IgA |
2 |
5-15 |
Limfocyty B |
Obecna w wydzielinach ustrojowych; hamuje proliferację mikroorganizmów. |
IgD |
0.03 |
<1 |
Limfocyty B |
Służy jako receptor błonowy limfocytów B |
IgE |
0.0003 |
<1 |
Komórki tuczne / Bazofile |
Stymuluje komórki tuczne do uwalniania histaminy, heparyny, leukotrienów; stymuluje eozynofile do uwalniania czynników chemotaktycznych; odpowiedzialna za reakcje anafilaktyczną |
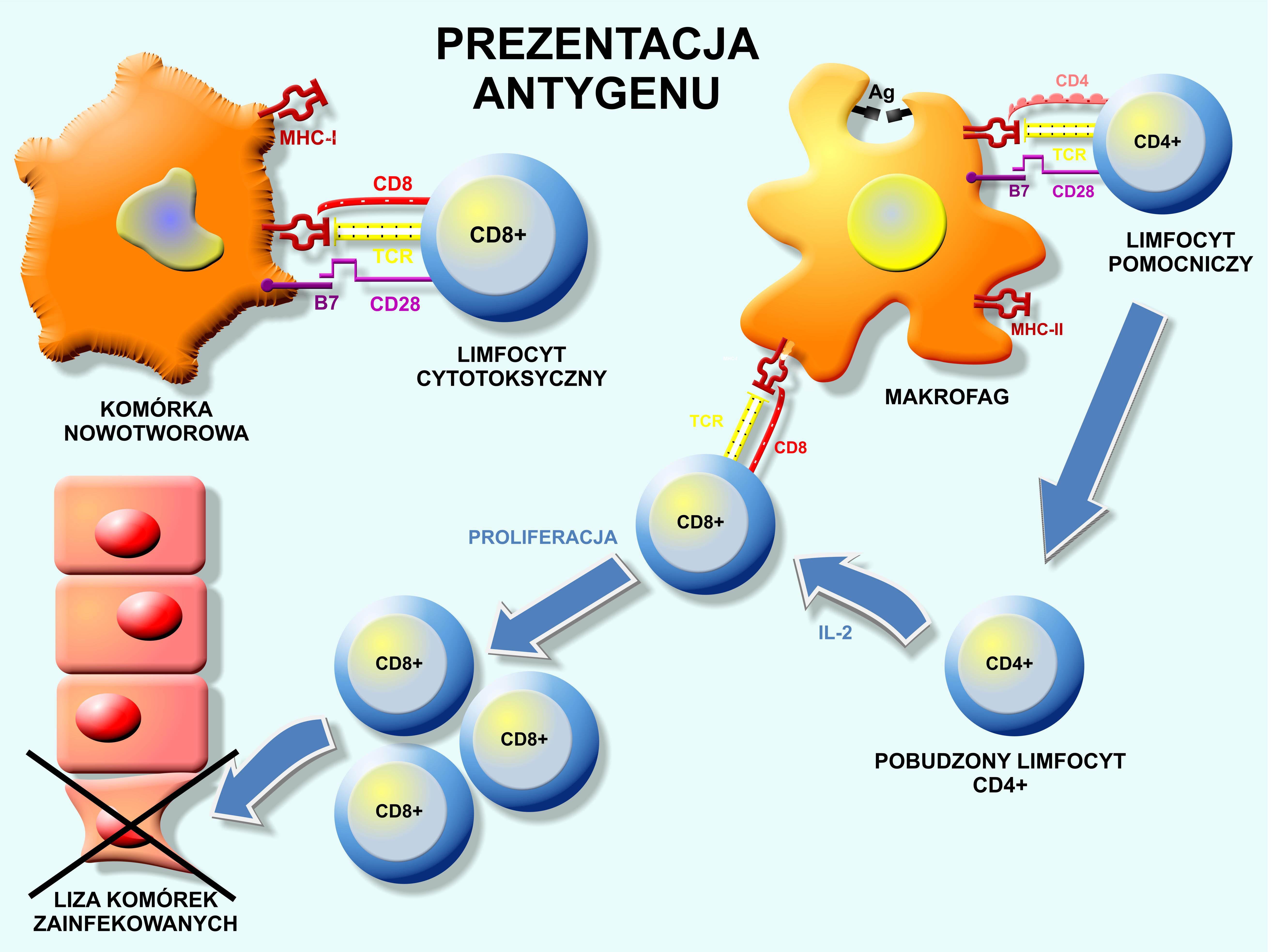
Ryc. 1. Prezentacja antygenu za pośrednictwem antygenów układu MHC klasy I i II. Prezentacja antygenów w połączeniu z cząstkami MHC klasy I prowadzi do rozpoznania tych antygenów przez limfocyty T cytotoksyczne (CD8+) z następowym niszczeniem tych komórek (komórki nowotworowe). Do rozpoznania komórki obcej przez limfocyt T za pośrednictwen antygenów MHC i receptorów limfocytarnych T (TCR) niezbędne jest wzmocnienie sygnały (ang.: costimulatory signal) w następstwie interakcji antygenu B7 komórki „obcej” z limfocytarnym receptorem CD28. W wyniku obu tych interakcji w przypadku układu MHC klasy I i limfocytów cytotoksycznych dochodzi do lizy komórki „obcej”. Prezentacja antygenów za pośrednictwem klasy II MHC charakterystyczna dla klasycznych komórek prezentujących antygeny prowadzi do ich prezentowania limfocytom zarówno CD8 jak i pomocniczym (CD4). Te drugie po pobudzeniu w następstwie prezentacji antygenu zaczynają wydzielać interleukinę 2 która powoduje proliferację pobudzonych limfocytów CD8 które z kolei eliminują komórki zainfekowane.
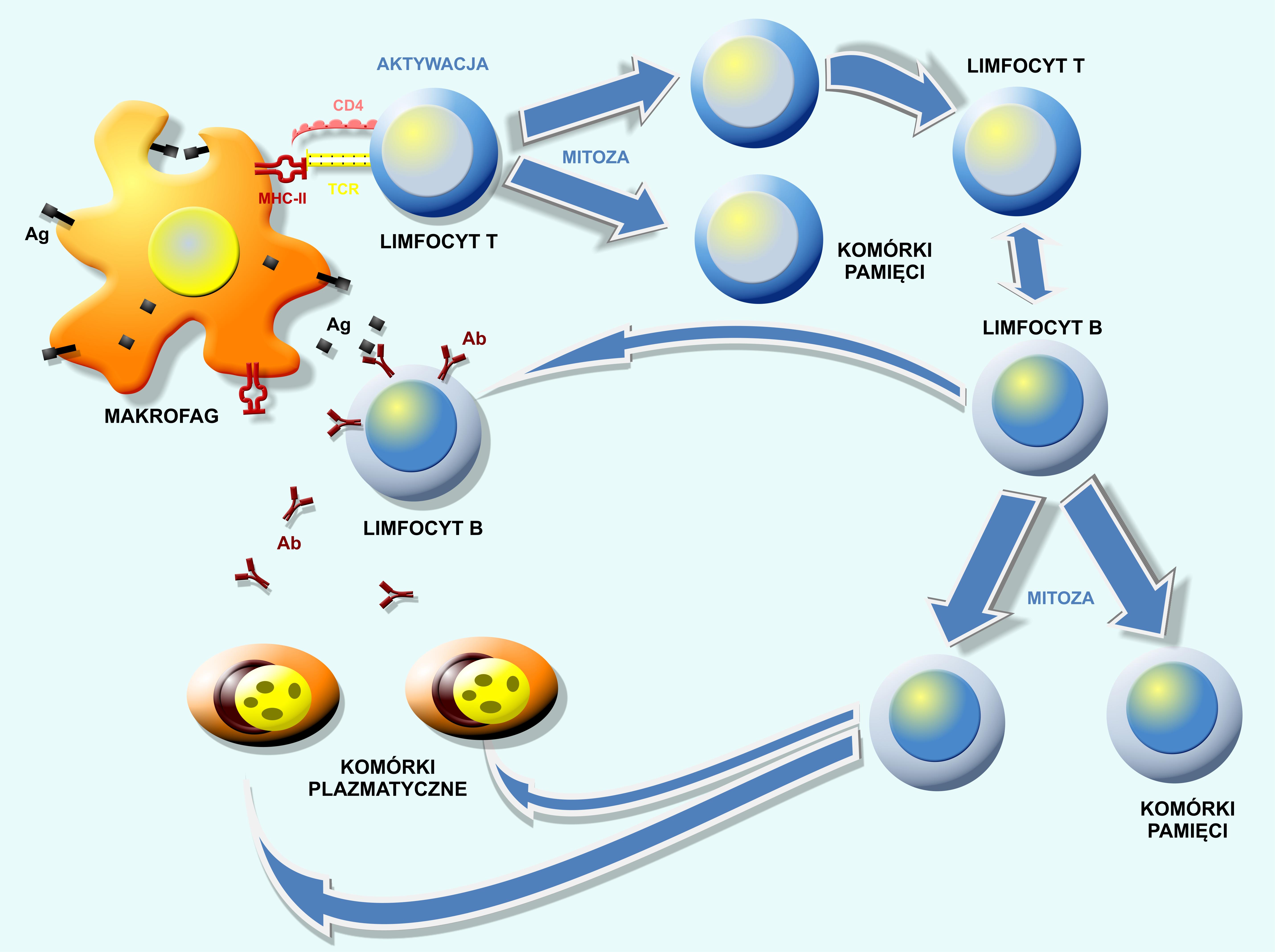
Ryc. 2. Schemat aktywacji limfocytów B przez pobudzone limfocyty pomocnicze CD4(+). Makrofagi, po sfagocytowaniu i przetworzeniu antygenu prezentują go za pośrednictwem cząstek MHC klasy II limfocytom pomocniczym T (CD4+). W następstwie pobudzenia, limfocyty te wchodzą w cykl mitoz (ang.: clonal expansion). W kolejnym etapie limfocyty pomocnicze T wchodzą w bezpośrednią interakcję z limfocytami B powodując ich aktywację, która wzmacniana jest także uwalnianymi przez limfocyty pomocnicze T interleukinami (IL-2, IL-4, IL-5, IL-10, IL-13). W następstwie aktywacji limfocyty B wchodzą w cykl mitotyczny. W rezultacie tworzą się trzy linie pochodne: a/ limfocyty ze specyficznymi przeciwciałami powierzchniowymi służącymi do wiązania antygenów rozpuszczalnych; b/ limfocyty B pamięci immunologicznej, oraz c/ komórki plazmatyczne, będące wysoko zróżnicowanymi limfocytami B produkującymi przeciwciała. Konspekt: Układ limfatyczny
Układ limfatyczny zwany także układem immunologicznym jest zbiorem ściśle ze sobą połączonych systemów odpornościowych, które umożliwiają organizmowi zwalczanie infekcji, obronę przed innymi obcymi antygenami w tym także komórkami nowotworowymi.
Układ limfatyczny składa się z:
centralnych narządów limfatycznych (grasica i szpik kostny)
obwodowych narządów limfatycznych (śledziona i węzły limfatyczne)
tkanki limfoidalnej
rozproszonej (limfocytów krwi i tkanki łącznej właściwej)
grudkowej (grudki chłonne, migdałki, kępki Peyera)
naczyń limfatycznych i limfy
Grasica i szpik kostny odgrywają zasadniczą rolę w czynnościowym dojrzewaniu limfocytów, dlatego nazywamy je centralnymi narządami limfatycznymi.
Najważniejszymi komórkami układu limfatycznego są limfocyty oraz komórki prezentujące antygen (komórki dendrytyczne, makrofagi) a najważniejszymi cząstkami są immunoglobuliny i receptory limfocytów T wiążące antygen. Po opuszczeniu centralnych narządów limfatycznych limfocyty T i B gromadzą się głównie w odpowiednich obszarach obwodowych narządów limfatycznych:
limfocyty T w obszarach grasiczozależnych (pas przykorowy węzła chłonnego)
limfocyty B w obszarach grasiczoniezależnych (grudki limfatyczne węzła chłonnego)
Antygeny są to substancje mające następujące właściwości:
immunogenność, tj. zdolność wywoływania przeciw sobie swoistej odpowiedzi immunologicznej
antygenowość, tj. zdolność swoistego łączenia się z immunoglobulinami i receptorami limfocytów T. Antygeny mające tylko tę drugą właściwość nazywamy haptenem. Immunogenność uzyskuje on dopiero po połączeniu z nośnikiem, najczęściej cząstką białka.
W obrębie układu odpornościowego występują trzy mechanizmy obrony immunologicznej a mianowicie:
mechanizmy ochrony powierzchniowej (lizozym, kwaśne środowisko)
układ immunologiczny wrodzony i związane z nim mechanizmy odporności nieswoistej (ang.: the innate immune system)
układ immunologiczny nabyty i związane z nim mechanizmy odporności swoistej (ang.: the adaptive immune system)
Ochrona powierzchniowa oraz odporność nieswoista stanowią pierwszą linię obrony i skład jej wchodzą zarówno komórki immunologiczne (makrofagi, granulocyty, komórki NK, histiocyty), a także układ dopełniacza, lizozym, interferon).
Wyszukiwarka
Podobne podstrony:
Układ chłonny i n zmysłów
UKŁAD CHŁONNY, GWSH, fizjologia
7 UKLAD CHLONNY id 44983 Nieznany
7 Układ chłonny
UKŁAD CHŁONNY, Anatomia człowieka
UKLAD CHLONNY.REFERAT, fizjologia
UKLAD CHLONNY, Technik Usług Kosmetycznych (TUK), anatomia i fizjologia TUK
Histologia Krążenie i Układ Chłonny, Lekarski WLK SUM, lekarski, Histologia, histologia zabrze
Układ chłonny klatki piersiowej, Anatomia
Histologia Krążenie i Układ Chłonny, ŚUM, I rok, Histologia, Skrypty histologia ŚUM
UKŁAD CHŁONNY
Uklad chlonny
Anatomia Układ chłonny
Układ chłonny nerwowy narządy zmysłów(2), kosmetologia licencjat, anatomia
Anatomia i fizjologia układ krążenia, układ chłonny, błony surowicze
Układ chłonny 2
Szyja układ chłonny
więcej podobnych podstron