
pH = -log [H30+] pOH = -log [OH-] pH-+ + pOH- = 14 [OH-] = 10 -pOH
[H3O] = 10-pH
Mocny kw HBr HCl HJ H2SO3 HNO3 HCIO4 NaOH KOH NH4Cl Kwasy słabe H2SO3, H2S, H2CO3, CH3COOH, NH3, H2O, NH4OH; Mg(OH)2; Mg4OH; Fe(OH)
Mocne zasady KOH, NaOH, MgOH, Ca(OH)2; Ba(OH)2; Słabe zasady Al.(OH)2, Cu(OH)2, Pb(OH)2 Chlorek amonu NH4CL Amoniak NH
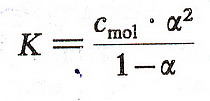
IPrzejście z masy na mole M = gram : masę 2gr C mc = 2gr : 12 = 0,16 mola
Moc kwasu pKa=-log10[Ka]
Ka-stała dyso. Im pKb jest mniejsze moc kwasu większa
Moc zasady pKb=-log10[Kb]
Kb-stała dysocjacji
Im pKb < moc zasady jest większa
Kw = [H3O]*[OH-]
Oznaczanie
zawartości kwasu solnego HCl w oznaczonym roztworze.
1000 cm3 1M KOH reaguje z 35,47 g HCL
V cm3 C1 M KOH reaguje z x g HCl
Preparatyka chemiczna
1. Oblicz ile moli i ile gramów siarczanu IV sodu można otrzymać wreakcji 1,613 g wodorotlenku sodu i kwasu siarkowego.
2NaOH + H2SO4 = Na2SO4 + 2 H2O
M 2 * 39,997 g/mol NaOH reaguje z 142,04 g/mol Na2SO4
1,316 g NaOH reaguje z X g NaOH
2. Oblicz zawartość % chromu w próbce zawierającej (NH4)2Cr2O7 czystego oraz procentową zawartość chromu w próbce zawierającej 10% zanieczyszczeń niechromowych.
M (NH4)2Cr2O7 = 252 g/mol
1 mol (NH4)2Cr2O7 zawiera 2 mole Cr
252g (NH4)2Cr2O7 zawiera 2*52g Cr
100g (NH4)2Cr2O7 zawiera x g
252g - 90%
2*52g CR - x%
Odp. Zawartość % w próbce (NH4)2Cr2O7 wynosi 41,27% a w 10% - 37,14 %
3. M Al2(So4)3 =342g / mol M 2* (AlNH4(SO4)2)= 474g / mol
8,5 g mt g
Pomiar gęstości roztworów.
1. W 1,5 dm3 roztworu znajduje się 425g chlorku sodu oblicz stężenie molowe tego roztworu. MNaCl =58,5g/mol
2. Oblicz stężenie procentowe roztworu otrzymanego po rozpuszczeniu 35g substancji w 150g wody.
ms = 35g mrozp 150g
mr = mroap + ms = 150g + 35g = 185g
2. Określ liczbę moli substancji rozpuszczonej zawartej w 1,49 dm3
AgNO 3 = 0,35g roztworu
M AgNO 3 = 170g/mol
ms = n*M AgNO 3 = 0,35 * 170 = 59,5g
mr = d * V = 1,49* 100 = 149
3. Ile gramów wody należy dodać do 60% roztworu siarczanu (VI0 potasu, aby otrzymać 1800g 10% roztworu tej soli ?
Wynika stąd, że wagowy stosunek 60% roztworu siarczanu (VI) potasu do wody wynosi 10:50 = 1:5 czyli że 1800g 10% roztworu składa się z 1 części wagowej 60% roztworu siarczanu (VI) potasu oraz 5 części wagowych wody.
1800g: 6 części wagowych = 300g 5* 300 = 1500g
Odp. Chcąc otrzymać 1800g 10% roztworu musimy wziąć 1500g wody i 300g 60% roztworu
Hydroliza soli Sól +woda =kwas + zasada
Me+ + A- = MeOH- + HA
Mocnych kwasów i mocnych zasad nie zachodzi.
HCL, H2SO4, HNO3,HClO3, HClO4, HBr, HJ,
Mocne zasady = metal gr. 1
NaOH, LiOH, KOH, oraz niektóre gr. 2
Ca(OH)2, Ba(OH)2
Mocny kwas + Słaba zasada = odczyn kwaśny
NH4+CL-+ H2O = NH+4OH-+ HClNH+4 + Cl- + H2O = NH4OH + H++ Cl-
NH+4 + H2O = NH4OH + H+
Słabych kwasów + słabych zasad = odcz obojęt
CH3COO- + NH4+ +H2O = CH3COOH + NH4+OH
Słaby kwas + mocna zasada = odczyn zasadowy
Na+CH3COO- + H2O =Na+ +OH- + CCH3COOH
CH3COO- + H2O = CCH3COOH + OH-
Reakcja zobojętniania.Kwas + zasada = sól + woda
H+2SO42- + 2 Na+OH- = Na+2 SO42- + 2 H2O
2H+ + SO42 + 2 Na+ + 2OH- = 2Na+ + SO42- + 2 H2O
2H+ + 2OH- = 2 H2O / : 2
H+ + OH- = H2O
Kwas + wodorotlenek = sól + woda
2HClO4 + 2Mg(OH)2 = 2MgClO4 + 2H2O
Metal aktywny + Kwas = sól + H2
Mgo + H+2 SO42 = Mg+2 SO42- + H+2
Mgo + 2H++ SO42 = Mg+2 + SO42- + H+2
Mgo + 2H+= Mg+2 + H+2
Tlenek metalu + kwas = sól + woda
MgIIOII+ 2HIClI = MgIIClI2 + H2O
Sól I + kwas I = Sól II + kwas II
AgIINo3 + HIClI = AgIClI + HINOI3
Ag + NO3 + H + Cl = AgIClI + H + NOI3
Ag + Cl = AgCl
SólI + SólII = SólIII + SólIV
BaIIClI2 + KI2SOII4 = BaIISOII4 + 2KIClI
Ba2+ + 2Cl- + 2K+ + So2- 4 = BaSo4 + 2K+ + 2Cl-
Ba2+ + SO2-4 = BaSO4
Tlenek kwasowy + zasada (wodorotlenek) = sól + woda
CO2 + Ca (OH)2 = CaCO3 + H2O
Metal + niemetal = sól
2Na + S = Na2S
tlenek metalu + tlenek kwasowy = sól
K2O + SO2 = K2SO3
Sól I + zasada I = sól II + zasada II
Na2So4 = Ba(OH)2 = Ba2+2(SO4)-22 + 2Na+OH-
2Na+ + SO-24 + Ba+2 + 2OH = Ba+2 + SO-24 + 2Na+ + 2OH-
SO-24 + Ba+2 = Ba+2So-24
Dysocjacja jonowa - rozpad cząsteczki elektrolitów na jony
Odczyn roztworu pH
H2O = H- + OH-
Kwasy b+ H2O = nie metal. + H
H+Cl-+ = Cl-+ H+-
Kw tlenowe = tlenek niemetalu + H2
H2SO4 = H2 + SO4 (tlenek kwasowy)
Metal aktywny + H2O = zasada + H2
2Na + 2H2O = 2NaOH + H2
Dysocjacja jonowa soli
(NH)4SO4 + 2H2O = 2NH3 · H2O + H2SO4
2NH4+ + SO-24 + 2H2O = 2NH3+ · H2O + H+2 + SO-24
2NH4+ + 2H2O = 2NH3 · H2O + H+2 odczyn kw
Na2CO3 + 2H2O = 2NaOH + H2CO3
CO-23 + 2H2O = H2CO3 + OH- odczyn zasadowy
(NH4)2CO3 + 2H2O = 2 NH3 · H2O + H2CO3
2NH+4 + CO-23 + 2H2O = 2 NH3 · H2O + H2 CO3
metal + kwas → sól + wodór
(nie dotyczy metali szlachetnych i półszlachetnych)
tlenek metalu + kwas → sól + woda
zasada + kwas → sól + woda
tlenek metalu + tlenek niemetalu → sól
(dotyczy tylko soli kwasów tlenowych)
wodorotlenek metalu + tlenek niemetalu →
sól + woda (dotyczy tylko soli kwasów tlenowych)
metal + niemetal → sól
(dotyczy tylko soli kwasów beztlenowych)
kwas 1 + sól 1 → sól 2 + kwas 2
sól 1 (rozp w wodzie) + sól 2 (rozp w wodzie)
→ sól 3 (nierozpuszczalna) + sól 4 (rozpuszczalna)
sól met. słabego + metal aktywny → sól + metal
metal 1 + sól 1 → metal 2 + sól 2
zasada 1 + sól 1 → zasada 2 + sól 2
tlenek niemetalu + zasada → sól + woda
(dotyczy tylko soli kwasów tlenowych)
np. siarczek miedzi(II) CuS
CuO + H2S → CuS + H2O
Cu(OH)2 + H2S → CuS + 2H2O
Cu + S → CuS
H2S + CuCl2 → CuS↓ + 2HCl
Na2S + CuCl2 → CuS↓ + 2NaCl
lub fosforan(V) magnezu Mg3(PO4)2
3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2
3MgO + 2H3PO4 → Mg3(PO4)2 + 3H2O
3Mg(OH)2 + 2H3PO4 → Mg3(PO4)2 + 6H2O
60% 10- 0 = 10g 1
10
0% 60-10 = 50g 5
Wyszukiwarka
Podobne podstrony:
Tab Mend Audyt
lab.2 tab
lab 2 tab
BD Lab Tab
tab cw, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab
spis lab I sem 2010
III WWL DIAGN LAB CHORÓB NEREK i DRÓG MOCZ
Diagnostyka lab wod elektrolit
ZW LAB USTAWY, OCHRONA
LAB PROCEDURY I FUNKCJE
sprzet lab profilografy
sprzet lab mikromanometry
Mechanika Plynow Lab, Sitka Pro Nieznany
Lab 02 2011 2012
PO lab 5 id 364195 Nieznany
więcej podobnych podstron