
pH = -log [H30+] pOH = -log [OH-] pH-+ + pOH- = 14 [OH-] = 10 -pH
[H3O] = 10-14 : [OH- ]
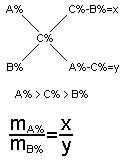
Mocny kw HBr HCl HJ H2SO3 HNO3 HCIO4 NaOH KOH NH4Cl Kwasy słabe H2SO3, H2S, H2CO3, CH3COOH, NH3, H2O, NH4OH; Mg(OH)2; Mg4OH; Fe(OH)
Mocne zasady KOH, NaOH, MgOH, Ca(OH)2; Ba(OH)2; Słabe zasady Al.(OH)2, Cu(OH)2, Pb(OH)2 Chlorek amonu NH4CL Amoniak NH
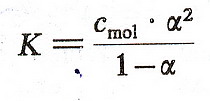
Moc kwasu pKa=-log10[Ka] Ka-stała dyso. Im pKb jest mniejsze moc kwasu większa
Moc zasady pKb=-log10[Kb] Kb-stała dysocjacji Im pKb < moc zasady jest większa
Kc = [H3O]*[OH-] [H3O] = 10-14 : [OH- ] pH + pOH = 14
Kwas (oddaje) sprzężony z zasadą (przyj)
HCl + H2O → H3O- + CO32+ ; CN + H2O →HCN+OH-
Zasada (przyjmuje)sprzężona z kwasem (oddaje)
Wyszukiwarka
Podobne podstrony:
Tab Mend Lab
Audyt personalny 1a stud
Audyt strony drugiej i wewnętrzne audyty jakości
7 Wykl 7 str 4 tab 1 N 5 id 612 Nieznany (2)
DGP 2014 02 24 rachunkowosc i audyt
audyt projektu EFS (2)
glosariusz terminów biznesowych audyt i skrótów
Audyt wewnetrzny (SGHowy) Stand Nieznany (2)
Tab 65, Studia, 1 rok, od Magdy, FIZYKA, Fizyka, Labolatorium
Tab.7, Studia, Semestr II, Zarządzanie, SWOT
RMI Dz-bud i tab-inf 020626, Budownictwo, Prawo
TAB, kosmetologia 1
TAB, kosmetologia 1
378 audyt spraw, Audyt Wewnętrzny
Tab-wart stan, SWPS, Systemy motywacyjne w firmie
tab imip a4, AiR WIP, IV semestr, PRZTS Przetwórstwo tworzyw sztucznych, projekt
went tab
więcej podobnych podstron