Data wykonania ćwiczenia: 23.10.2009r.
Kinetyka reakcji hydrolizy skrobi hydrolizowanej przez inwertazę
Sprawozdanie z zajęć laboratoryjnych z
Przedmiotu Biotechnologia enzymatyczna
Cel wykonania ćwiczenia:
Wyznaczenie stałej Michaelisa- Menten oraz szybkości maksymalnej dla reakcji hydrolizy sacharozy katalizowanej przez inwertazę.
Opis wykonanego ćwiczenia:
Grupa została podzielona na 5 sekcji, z których każda badała roztwór o określonym stężeniu sacharozy w buforze octanowym
sekcja nr 1: 0,5g/ml
sekcja nr 2: 1 g/ml
sekcja nr 3: 2 g/ml
sekcja nr 4: 3 g/ml
sekcja nr 5: 4 g/ml
Przez każdą z sesji zostało przygotowane 100 ml roztworu sacharozy w buforze stanowym. W tym celu do kolby o pojemności 100 ml wsypano odważoną wcześniej ilość sacharozy (przykładowo sekcja 1 dodała 0,5 g, natomiast sekcja 2g sacharozy), następnie odlano do kreski (do 100ml) buforu octanowego. Całość wymieszano do rozpuszczenia.
Każda z sekcji pobrała z tak przygotowanego roztworu sacharozy 25 ml do osobnej kolby. Następnie w kolejności od sekcji nr 1 do sekcji nr 5, dodawano taka samą ilość enzymu- inwertazy (0,05ml), mieszano. Zawartość kolby przelewano do rurki polarymetrycznej, oraz mierzono kąt skręcania po 2, 4, 6, 8 i 10 minutach od wprowadzenia inwertazy do roztworu. W celu ograniczenia błędów pomiarowych, pomiary rozpoczęto od roztworu o najmniejszym stężeniu sacharozy.
Po zakończeniu pomiarów przez sekcję poprzednią, przepłukiwano dokładnie rurkę polarymetru, przed wlaniem kolejnego roztworu sacharozy o innym stężeniu. W każdej próbie pamiętano, by w żadnym wypadku w rurce polarymetru nie znajdował się żaden pęcherzyk powietrza, który znacznie wpływałby na wyniki.
Pomiary i obliczenia
Czas [min] |
Skręcalność [stopnie] |
Stężenie substratu, Cs [g/100ml] |
Stężenie produktu, Co-Cs, [g/100ml] |
Szybkość V8, [g/min] |
1/C8 |
1/V8 |
Stężenie sacharozy=0,5g/ml |
||||||
2 |
0,43 |
0,3644 |
0,1356 |
0,031250 |
4,0260 |
32,00 |
4 |
0,35 |
0,3180 |
0,1820 |
|
|
|
6 |
0,28 |
0,2774 |
0,2226 |
|
|
|
8 |
0,23 |
0,2484 |
0,2516 |
|
|
|
10 |
0,17 |
0,2136 |
0,2864 |
|
|
|
Stężenie sacharozy=1g/ml |
||||||
2 |
1,21 |
0,9318 |
0,0682 |
0,038975 |
1,4530 |
25,66 |
4 |
1,08 |
0,8564 |
0,1436 |
|
|
|
6 |
0,93 |
0,7694 |
0,2306 |
|
|
|
8 |
0,79 |
0,6882 |
0,3118 |
|
|
|
10 |
0,65 |
0,6070 |
0,3930 |
|
|
|
Stężenie sacharozy=2g/ml |
||||||
2 |
2,47 |
1,8926 |
0,1074 |
0,076500 |
0,7205 |
13,07 |
4 |
2,20 |
1,7360 |
0,2640 |
|
|
|
6 |
1,89 |
1,5562 |
0,4438 |
|
|
|
8 |
1,60 |
1,3880 |
0,6120 |
|
|
|
10 |
1,31 |
1,2198 |
0,7802 |
|
|
|
Czas [min] |
Skręcalność [stopnie] |
Stężenie substratu, Cs [g/100ml] |
Stężenie produktu, Co-Cs, [g/100ml] |
Szybkość V8, [g/min] |
1/C8 |
1/V8 |
Stężenie sacharozy=3g/ml |
||||||
2 |
3,06 |
2,46 |
0,54 |
0,146250 |
0,5500 |
6,84 |
4 |
2,73 |
2,27 |
0,73 |
|
|
|
6 |
2,36 |
2,05 |
0,95 |
|
|
|
8 |
1,98 |
1,83 |
1,17 |
|
|
|
10 |
1,63 |
1,63 |
1,37 |
|
|
|
Stężenie sacharozy=4g/ml |
||||||
2 |
4,45 |
3,5026 |
0,5044 |
0,107275 |
1,1652 |
9,32 |
4 |
4,26 |
3,3924 |
0,6146 |
|
|
|
6 |
4,06 |
3,2764 |
0,4306 |
|
|
|
8 |
3,84 |
3,1488 |
0,8582 |
|
|
|
10 |
3,60 |
3,0096 |
0,9974 |
|
|
|
1. Zanotowano wartości stopni skręcalności oraz czasu, natomiast pozostałe zamieszczone w tabeli powyżej zostały obliczone według sposobu podanego w instrukcji do ćwiczeń tj.:
stężenie substratu: Cs=1,16/l*α+0,23*Co
gdy:
l- długość rurki polarymetrycznej [dm]
α- kąt skręcania [stopnie]
Co- stężenie wagowe sacharozy na początku pomiarów [g/100ml]
Przykład wykorzystania wzoru (wartości dla stężenia równego 0,5g/ml oraz pomiaru skręcalności dla czasu 2 min):
Cs=1,16/2*0,43+0,23*0,5=0,3644 [g/100ml]
stężenie produktu: Cp=Co-Cs
Przykład wykorzystania wzoru dla wartości podanych w podpunkcie a
Cp=0,5-0,3644=0,1356[g/100ml]
szybkość V8
Wyliczona przy pomocy wykresów stężenia produktu od czasu. Po przeprowadzeniu stycznej do krzywej w punkcie t=8, V8 jest równa tangensowi kąta pomiędzy styczną a osią OX, a więc stosunkowi stężenia produktu w czasie 8 min do czasu t8.
Przykład dla stężenia sacharozy równego 0,5 g/ml
V8=0,2516/8=0,031250[g/min]
1/C8 oraz 1/V8
Są to wartości odwrotności odpowiednio stężenia substratu w czasie 8 min oraz prędkości V8 .
Przykład dla stężenia sacharozy równego 0,5 g/ml
1/C8=1/0,2484=4,026
1/V8=1/0,03125=32
2. Dla każdego stężenia sacharozy wykreślono zależność ilości wytworzonego produktu od czasu.
a) 0,5 [g/ml]
b) 1 [g/ml]
c) 2 [g/ml]
d) 3 [g/ml]
4 [g/ml]
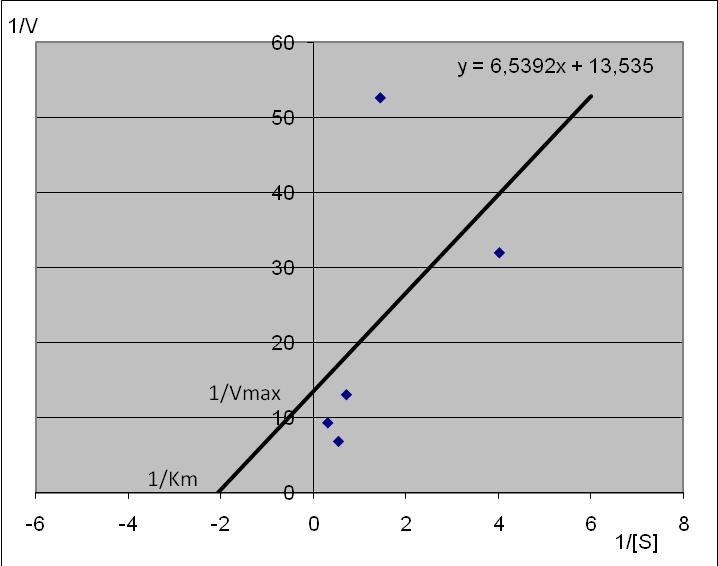
3. Graficzne przedstawienie równania Michaelisa- Mentena według Lineweavera-Burka.
WNIOSKI:
Podstawowym problemem w badaniu kinetyki reakcji enzymatycznej jest zmienna szybkość reakcji, która zależy od różnych czynników środowiska. W miarę prowadzonej reakcji jej szybkość maleje co jest spowodowane hamowaniem szybkości reakcji w miarę nagromadzającego się produktu. By znaleźć maksymalną szybkość reakcji katalizowanej enzymatycznie, należy zwiększać stężenie substratu do póki wzrost stężenia nie spowoduje dalszego przyspieszenia reakcji co przedstawia wykres Michaelisa - Menten. Analizując go można zauważyć, iż przy niewielkim stężeniu substratu w stosunku do stężenia enzymu szybkość reakcji rośnie liniowo, natomiast w przypadku dużego stężenia substratu, szybkość reakcji zbliża się do szybkości maksymalnej, a stężenie substratu nie wpływa już na jej zmianę.
Przedstawiając graficzne dane zebrane w tabeli na wykresie M - M, dla każdego stężenia substratu zauważymy asymptotyczny wzrost szybkości reakcji ku wartości maksymalnej, co oznacza, iż wszystkie miejsca aktywne enzymu zostają wysycone substratem.
W celu wyznaczenia parametrów reakcji enzymatycznej, sporządziliśmy wykres Lineweavera - Burka, na którym na osi y zostały odłożone odwrotności prędkości v8 a na osi x odwrotności stężenia c8, wyliczone dla poszczególnych początkowych stężeń sacharozy. Analizując wykres da się zauważyć zależność prędkości reakcji od wartości Km. Skoro Km jest to takie stężenie substratu, przy którym szybkość reakcji równa się połowie szybkości maksymalnej, stąd wniosek, iż wzrost wartości Km spowoduje wzrost szybkości reakcji i odwrotnie.
Analizując wykresy zmieniającej się ilości produktu od czasu widzimy, iż w miarę trwania reakcji, stężenie produktu rośnie, zmniejszając tym samym wartość stężenia substratu, jednak ze względu na ograniczony czas prowadzonej reakcji w laboratorium dla żadnego ze stężeń nie udało nam się uzyskać prędkości maksymalnej ani przebiegu zbliżającego się do prędkości maksymalnej.
Wartości Km oraz Vmax wyznaczyliśmy na podstawie wykresu L-B . Punkt przecięcia z osią x ma wartość -2,06983 i jest to wartość odpowiadająca wartości 1/Km natomiast punkt przecięcia z osią y ma wartość 13,535 i jest to wartość odpowiadająca wartości 1/Vmax. Co oznacza, że Km wynosi 0,48313 czyli jest to wartość stężenia, przy której prędkość reakcji równa się połowie szybkości maksymalnej natomiast Vmax dla naszych stężeń wynosi 0,07388.
Analizując wykres Lineweavera - Burka da się zauważyć, że nasze punkty pomiarowe znacznie odstają od wyznaczonej regresją liniową prostą. Błędy te mogą wynikać z błędu skręcalności właściwej zależnej od błędu współczynnika nachylenia ∆a i błędu jakim jest obarczona długość rurki l ( ∆l przyjmujemy za równą 1 mm). Należy też mieć na uwadze, że skręcalność właściwa świeżo przygotowanego roztworu cukru nie jest stała i dopiero po kilku godzinach przyjmuje wartość końcową, która stanowi ok. połowy wartości początkowej. Zjawisko to nazywamy mutarotacja. Błędy, które wyniknęły z niedociągnięć przeprowadzonych pomiarów można zniwelować, przeprowadzając doświadczenie jeszcze raz ze szczególnym zwróceniem uwagi na te czynności, w czasie których nastąpiły błędy.
Wyszukiwarka
Podobne podstrony:
BADANIE KINETYKI REAKCJI HYDROLIZY SACHAROZY KATALIZOWANEJ PRZEZ INWERTAZĘ Z DROŻDŻY
Bryjak, inżynieria bioreaktorów L, reakcja hydrolizy sacharozy katalizowana przez inwertazę
Wyznaczanie stałych równania kinetycznego reakcji hydrolizy sacharozy
Wyznaczanie stałych równania kinetycznego reakcji hydrolizy sacharozy
Kinetyka reakcji inwersji sacharozy
Kinetyka reakcji inwersji sacharozy, Studia, Politechnika
Kinetyka reakcji inwersji sacharozy
Sprawko biotech enzym kinetyka?
Kinetyka reakcji inwersji sacharozy
¦ćWICZENIE NR 6 Kinetyka reakcji inwersji sacharozy
04 Kinetyka reakcji chemicznych i kataliza
instrukcja kinetyka enzymatyczna - inwertaza, [1] Hydroliza sacharozy
3 3 Kinetyka reakcji katalitycznych
KATALIZA HOMOGENICZNA - REFERAT, KATALIZATORY- to substancje, które modyfikują kinetykę reakcji chem
Sprawozdanie Biochemia Kinetyka reakcji - polarymetr, Biotech, BIOTECHNOLOGIA, Semestr V, Biochemia,
04 Kinetyka reakcji chemicznych i kataliza
Laborki fizyczna kinetyka reakcji sacharozy wykres
Biotech enzym Zastosowanie lipaz do selektywnej hydrolizy estrów
więcej podobnych podstron