Referat z chemii
Ogniwa chemiczne
Autor: Łukasz Janota
Odkrycie elektryczności wywołało w XIX stuleciu rewolucyjny przewrót w świecie nauk przyrodniczych; w chemii dało szereg epokowych odkryć doświadczalnych. Objawy istnienia elektryczności statycznej znano od bardzo dawna, co najmniej od czasów starożytnych. Wiedziano, że pocieranie szkła nadaje mu szczególną właściwość - zdolność do odpychania innego, również potartego kawałka szkła lub przyciągania potartej wcześniej żywicy. Szybko zorientowano się, że istnieją dwa sposoby elektryzowania, czyli dwa rodzaje elektryczności. Początkowo mówiono o elektryczności szklanej i żywicznej (dziś - ebonitowej), później uzgodniono, że ten rodzaj ładunku, który wytwarza się na pręcie ebonitowym, zostanie nazwany „ujemnym”, ładunek zaś wytwarzany przez pocieranie szkła - „dodatnim”. Umowa ta przetrwała do dziś. Ładunek elektryczny, jakim obdarzony jest odkryty przez Thomsona elektron, oznacza się symbolem minus, ładunek protonu - symbolem plus. Niemniej fizyka nie wyjaśniła istoty samego zjawiska i w dalszym ciągu nie wiadomo dokładnie, czym jest ładunek elektryczny. Pozostaje więc jedynie opis zjawiskowy: ciała obdarzone ładunkami jednoimiennymi odpychają się, natomiast ciała obdarzone ładunkami różnoimiennymi przyciągają się; ładunek może przepływać z jednego ciała do drugiego, a ruch ładunków, zwany prądem elektrycznym, wywołuje efekty cieplne, magnetyczne i chemiczne.
Aż do końca XVIII wieku elektryczność statyczna była jedynym znanym rodzajem elektryczności. Zasadniczy zwrot nastąpił w 1800 roku po wynalezieniu pierwszych źródeł elektryczności, zwanych dziś ogniwami Volty lub ogniwami galwanicznymi dla uczczenia Volty i Galvaniego - autorów klasycznych prac z tej dziedziny. Ale co to jest to „ogniwo”?
”Jest to układ pozwalający na zmianę energii chemicznej na elektryczną kosztem reakcji chemicznej zachodzącej w tym układzie. Składa się on z dwóch przewodników metalicznych lub węglowych, zwanych elektrodami, zanurzonych w roztworze elektrolitu, przy czym albo elektrody sporządzone są z różnych materiałów, albo składy chemiczne elektrolitu w pobliżu elektrod są różne.” Ogniwo, którego elektrody nie są ze sobą połączone przewodnikiem elektrycznym, wykazuje między elektrodami określone napięcie elektryczne zwane siłą elektromotoryczną. Jeżeli elektrody połączyć poza elektrodami jakimś przewodnikiem, to zamknie się obwód i popłynie prąd - zarówno przez roztwór elektrolitu, jak i przez ten przewodnik. Napięcie między elektrodami zmniejsza się wówczas, a w pobliżu elektrod przebiegają reakcje chemiczne, których przebieg jest źródłem energii elektrycznej dostarczanej przez ogniwo chemiczne.
Ogniwa chemiczne możemy podzielić na trzy główne rodzaje:
Akumulatory;
Ogniwa chemiczne stosowane jako źródła energii elektrycznej, ale niepozwalające na ich powtórne ładowanie po wyczerpaniu;
Ogniwa chemiczne stosowane jako wzorce napięcia elektrycznego.
Najczęściej spotykanym ogniwem chemicznym drugiego rodzaju jest tzw. suche ogniwo elektryczne Leclanchégo, składające się z pręta węglowego otoczonego pastą, złożoną z wilgotnego chlorku amonowego, chlorku cynkowego, i dwutlenku manganu, i umieszczonego w naczyńku cynkowym. Podczas pracy tego ogniwa cynk utlenia się do jonów cynkowych, a dwutlenek manganu ulega redukcji. Takie ogniwa, łączone po trzy, są powszechnie używane jako bateryjki do latarek itp.
Ogniwa galwaniczne
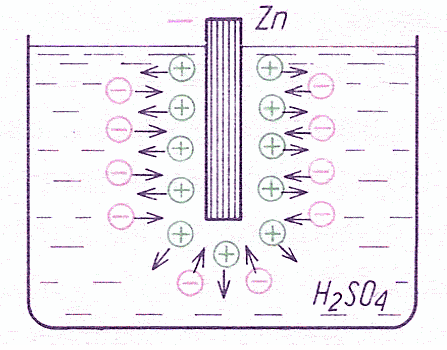
Dobrze, teorię już znamy. Ale jak to działa w praktyce? Załóżmy, że w kwasie siarkowym H2SO4 zostanie zanurzona elektroda cynkowa (rys. 1). Jony cynku Zn+ zanurzonego w elektrolicie wykazują tendencję do przechodzenia do elektrolitu. Jony metalu są dodatnie, w związku z czym elektrolit wykazuje ładunek dodatni, a cynk na powierzchni styczności z elektrolitem - ładunek ujemny. W obszarze styczności cynk-elektrolit powstaje pole elektryczne. W miarę rozpuszczania się cynku zwiększa się natężenie pola elektrycznego, które z kolei przeciwdziała przechodzeniu jonów cynku Zn+ do roztworu i w związku z tym po jakimś czasie ustala się stan równowagi. Stan równowagi następuje więc w wyniku zrównoważenia sił chemicznych, pod wpływem których następuje rozpuszczanie się cynku i sił elektrycznych hamujących ten proces. Rozpuszczanie się cynku ustaje przy pewnej wartości różnicy potencjałów pomiędzy elektrodą cynkową a elektrolitem. Potencjał cynku względem elektrolitu oznaczymy przez φ1.
Jeżeli w tym samym elektrolicie zanurzymy elektrodę z innego metalu, to opisany proces również będzie miał miejsce z tym jednak, że dla różnych metali (oraz dla węgla) ustala się inny potencjał względem elektrolitu, np. φ2. Wobec tego między dwoma elektrodami zanurzonymi w elektrolicie powstaje napięcie
Przykładowo potencjał elektrody miedzianej względem elektrody cynkowej, zanurzonych w roztworze kwasu siarkowego, wynosi 0,90 V (Volt - jednostka, w której mierzymy napięcie), a potencjał elektrody cynkowej wynosi 1,55 V.
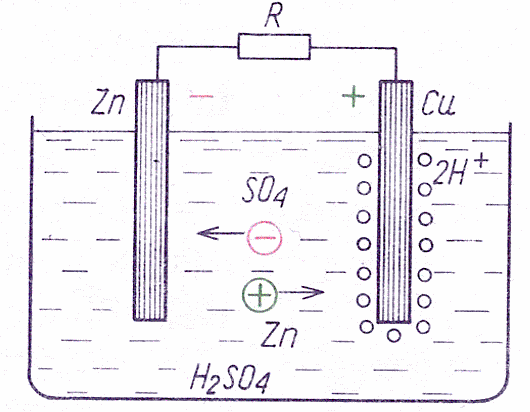
Biegunem ujemnym ogniwa jest z reguły cynk. Ogniwo mające elektrodę cynkową i elektrodę miedzianą należy do najstarszych ogniw i jest nazywane ogniwem Volty. Siła elektromotoryczna takiego ogniwa wynosi 0,9 V. Podczas użytkowania ogniwa cząsteczki H2SO4 ulegają dysocjacji, w wyniku czego jony ujemne SO42- dochodzą do katody Zn i po oddaniu dwóch elektronów tworzą wraz z Zn cząsteczki siarczanu cynku ZnSO4. Jony dodatnie 2 H+ dochodzą do anody Cu, dobierają brakujące elektrony i osiadają na elektrodzie pod postacią pęcherzyków wodoru. Wodór osiadający na elektrodzie miedzianej prowadzi do powstania tzw. napięcia polaryzacji, które obniża napięcie na zaciskach ogniwa (rys. 2). Procesy chemiczne zachodzące w ogniwie Volty można ująć wzorami:
Elektroda cynkowa
Elektroda miedziana
W celu uniknięcia szkodliwego działania polaryzacji stosuje się przy elektrodach dodatnich związki chemiczne oddające łatwo tlen. W wyniku połączenia tlenu z cząsteczkami wodoru powstaje woda. Związki przeciwdziałające zjawisku polaryzacji elektrody nazywamy depolaryzatorami. Depolaryzatorem jest m.in. dwutlenek manganu MnO2.
Innym rodzajem ogniwa galwanicznego jest ogniwo Leclanchego. Jako elektrody stosuje się węgiel i cynk, a elektrolitem jest roztwór salmiaku, czyli chlorku amonu NH4Cl. Elektroda węglowa jest umieszczona w płóciennym woreczku napełnionym mieszaniną sproszkowanego dwutlenku magnezu i węgla. Siła elektromotoryczna tego ogniwa wynosi 1,5 V. Procesy chemiczne zachodzące w ogniwie Leclanchego można ująć wzorami:
Elektroda cynkowa
Elektroda węglowa
Ogniwa typu Leclanchego są wykonywane jako ogniwa mokre, ogniwa półsuche i ogniwa suche (np. popularna bateryjka).
Z przeprowadzonych rozważań wynika, że siła elektromotoryczna ogniwa galwanicznego zależy od rodzaju użytych elektrod i rodzaju elektrolitu.
Wielkością charakteryzującą ogniwo jest pojemność elektryczna ogniwa, równa iloczynowi prądu znamionowego ogniwa i gwarantowanego czasu jego użytkowania przy tym prądzie. Pojemność elektryczną ogniwa wyraża się w amperogodzinach (Ah).
Ogniwa galwaniczne mają ograniczony zakres zastosowań. W jednostce czasu mogą one dostarczyć tylko niewielką ilość energii elektrycznej, a czas ich pracy jest krótki. Po rozładowaniu nie można ich ponownie naładować.
Akumulatory
Przejdźmy teraz do akumulatorów zwanych też ogniwami wtórnymi. Akumulator po wyładowaniu można ponownie doprowadzić do stanu całkowitego naładowania, przy czym proces ładowania i wyładowania można wielokrotnie powtarzać. Podczas ładowania akumulator jest zasilany z innego źródła energii, przy czym energia elektryczna jest zamieniana w energię chemiczną. W tej postaci energia może być magazynowana. Podczas wyładowania akumulator pracuje jako źródło energii elektrycznej i energia chemiczna jest z powrotem zamieniana w energię elektryczną.
Rozróżniamy akumulatory kwasowe (ołowiowe) i akumulatory zasadowe (żelazo-niklowe i kadmowo-niklowe).
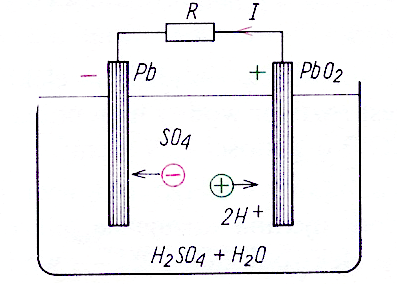
W akumulatorze ołowiowym (naładowanym) elektrodą ujemną jest ołów (Pb), elektrodą dodatnią jest dwutlenek ołowiu (PbO2), a elektrolitem - wodny roztwór kwasu siarkowego (H2SO4 + H2O). Podczas wyładowania elektroda ujemna (Pb) zamienia się w siarczan ołowiu (PbSO4), a wolne jony wodoru (H+) wędrują do elektrody dodatniej (PbO2), tworząc tu w połączeniu z kwasem siarkowym również siarczan ołowiu i wodę (rys. 3). W czasie wyładowania siarczan ołowiu tworzy się więc na obu elektrodach, a na skutek tworzenia się wody, gęstość kwasu maleje. Podczas ładowania reakcje są odwrotne, a zatem zmniejsza się liczba cząstek wody i gęstość kwasu siarkowego zwiększa się. W stanie naładowania płyta ujemna jest barwy szarej, płyta dodatnia - brunatnej. Napięcie naładowanego akumulatora wynosi ok. 2 V i nie zależy od wymiarów elektrod. Zwiększenie pojemności elektrycznej akumulatora ołowiowego uzyskuje się przez zwiększenie powierzchni elektrod. Elektrody akumulatora wykonuje się więc w postaci płyt żeberkowych mających dużą powierzchnię czynną, albo w postaci płyt masowych, których szkielet, wykonany w formie kraty z twardego ołowiu, wypełnia się masą czynną zawierającą tlenki ołowiu. Dalsze zwiększanie pojemności można uzyskać poprzez tworzenie elektrod wielopłytowych.
W akumulatorze zasadowym elektrolitem jest roztwór wodny ługu potasowego KOH.
W akumulatorze żelazo-niklowym jako elektrodę ujemną stosuje się żelazo (Fe), a jako elektrodę dodatnią - wodorotlenek niklu Ni(OH)3.
W akumulatorze kadmowo-niklowym jako elektrodę ujemną stosuje się kadm, a jako elektrodę dodatnią - również wodorotlenek niklu.
Akumulator zasadowy wykazuje w stosunku do akumulatora kwasowego większą odporność na wstrząsy mechaniczne i przeciążenia elektryczne oraz jest trwalszy. Akumulator zasadowy wytrzymuje do 3000 wyładowań, podczas gdy ołowiowy - do ok. 1500. Napięcie pracy akumulatora zasadowego wynosi 1,2 V.
Badania prowadzone nad nowymi typami akumulatorów idą w kierunku ich miniaturyzacji, zmniejszenia masy, zwiększenia pojemności, możliwości szybkiego ładowania, co wiąże się z tendencją do ich stosowania do napędu samochodów i zastąpienia silna spalinowego silnikiem elektrycznych.
Ogniwa paliwowe
Pora na ostatni, specjalny typ ogniwa galwanicznego. Podobnie jak każde ogniwo galwaniczne również ogniwo paliwowe składa się z dwóch elektrod - anody i katody - rozdzielonych elektrolitem. Jest to urządzenie, w którym energia spalania paliwa (paliwo może być w postaci stałej, ciekłej lub gazowej) zostaje bezpośrednio zamieniona w energię elektryczną. Ogniwo paliwowe można traktować jak ogniwo galwaniczne wtórne różniące się jednak od akumulatora tym, że substancje czynne np. wodór i tlen, są poza ogniwem i dlatego dzięki możliwości ciągłego ich dostarczania do elektrod ogniwa mogą pracować bez przerwy.
Ogniwo paliwowe najprostszego typu, zasilane wodorem i tlenem, działa w odwrotny sposób do urządzenia produkującego tlen i wodór w elektrochemicznej reakcji elektrolizy wody. Doprowadzając wodór do anody, a tle do katody obserwuje się powstanie między nimi różnic 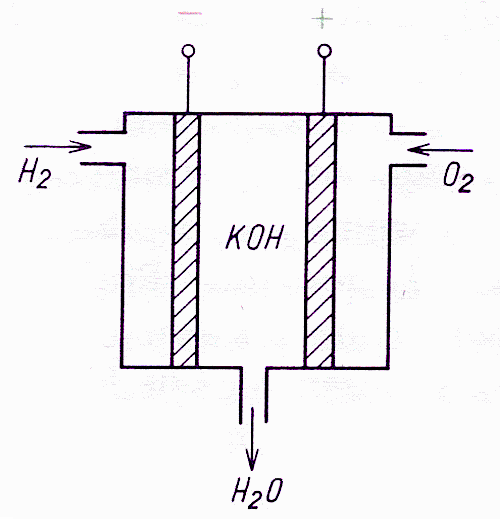
potencjałów. Urządzenie można, więc wykorzystać jako źródło energii elektrycznej (rys. 4). Energia elektryczna wytwarzana jest bez zanieczyszczania środowiska.
Do zalet ogniwa paliwowego można zaliczyć brak ruchomych, ścierających się części konstrukcyjnych, długi czas pracy, dużą odporność na przeciążenia i prostą obsługę, do wad zaś małą moc osiągalną, niskie napięcie pracy, wysoki koszt urządzeń oraz konieczność stosowania czystych, kosztownych paliw.
Ogniwa paliwowe znalazły praktyczne zastosowanie tam, gdzie cena urządzenia i ekonomia jego pracy mają znaczenie drugorzędne. Użyto ich w pojazdach kosmicznych serii Gemini i w pojazdach programu Apollo.
Literatura:
„Mały słownik chemiczny” (wydanie V) wyd. „Wiedza Powszechna”, Warszawa 1976r.
„Chemia dla kandydatów na wyższe uczelnie” (wydanie III) K. M. Puzdro, wyd. PWN, Warszawa 1983r.
„Elektrotechnika” (wydanie IV) Stanisław Bolkowski, wyd. WSiP, Warszawa 1993r.
„Chemia ogólna i nieorganiczna” (wydanie VI) A. Bielański, wyd. PWN, Warszawa 1979r.
„Encyklopedia popularna PWN” (wydanie XXVIII) wyd. PWN, Warszawa 1998r.
Sir Joseph Jon Thomson (1856-1940) - fizyk angielski; twórca podstaw nauk o budowie materii i strukturze elektryczności; odkrywca elektronu; współodkrywca trwałych izotopów neonu; dostał nagrodę Nobla.
Siła elektromotoryczna (SEM, siła ektrobodźcza) - różnica potencjałów elektrycznych między elektrodami ogniwa chemicznego w chwili, gdy przez ogniwo nie płynie prąd. W czasie przepływu prądu różnica potencjałów między elektrodami maleje lub rośnie; gdy ogniwo wytwarza prąd, siła elektromotoryczna jest mniejsza. Przyczyną jest z, jednej strony, równoważenie przez siłę elektromotoryczną spadków napięcia wywołanych przepływem prądu zarówno zewnętrznej, jak i wewnętrznej części obwodu, z drugiej - występowanie polaryzacji elektrodowej zmniejszającej siłę elektromotoryczną ogniwa pracującego w porównaniu z ogniwem będącym w stanie spoczynku.
Katoda - elektroda doprowadzająca do układu ładunki ujemne.
Anoda - elektroda pobierająca z roztworu ładunki ujemne.
Ług - nazwa zwyczajowa roztworów wodnych mocnych zasad.
7
Rysunek 1 - Elektroda cynkowa Zn zanurzona w kwasie siarkowym H2SO4
Rysunek 2 - Zasada działania ogniwa Volty
Rysunek 3 - Akumulator ołowiowy pracujący jako źródło energii elektrycznej
Rysunek 4 - Schemat poglądowy ogniwa paliwowego
Wyszukiwarka
Podobne podstrony:
07 Ogniwa chemiczne i Współczynniki aktywności
Pomiar pojemności ogniwa chemicznego
tez cos o ogniwach st. , Ogniwa chemiczne
Cw2 Ogniwa chemiczne
Ogniwa chemiczne, Chemia
ogniwa chemiczne, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
Ogniwa chemiczne
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
ogniwa-i-akumulatory, Technologia Chemiczna PG
SEM ogniwa, technologia chemiczna, chemia fizyczna, srawozdania
SEM ogniwa2, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Aparatura chemiczna wirówki
Prezentacja Składniki chemiczne kwasu nukleinowego
więcej podobnych podstron