1. Średnia próbka laboratoryjna
część próbki ogólnej (otrzymanej przez jej dokładne wymieszanie i prawidłowo przeprowadzone zmniejszenie) przeznaczona do przeprowadzenia badan laboratoryjnych, opakowana i przechowywana w sposób zapewniający jej niezmienność
2. Metoda koperty
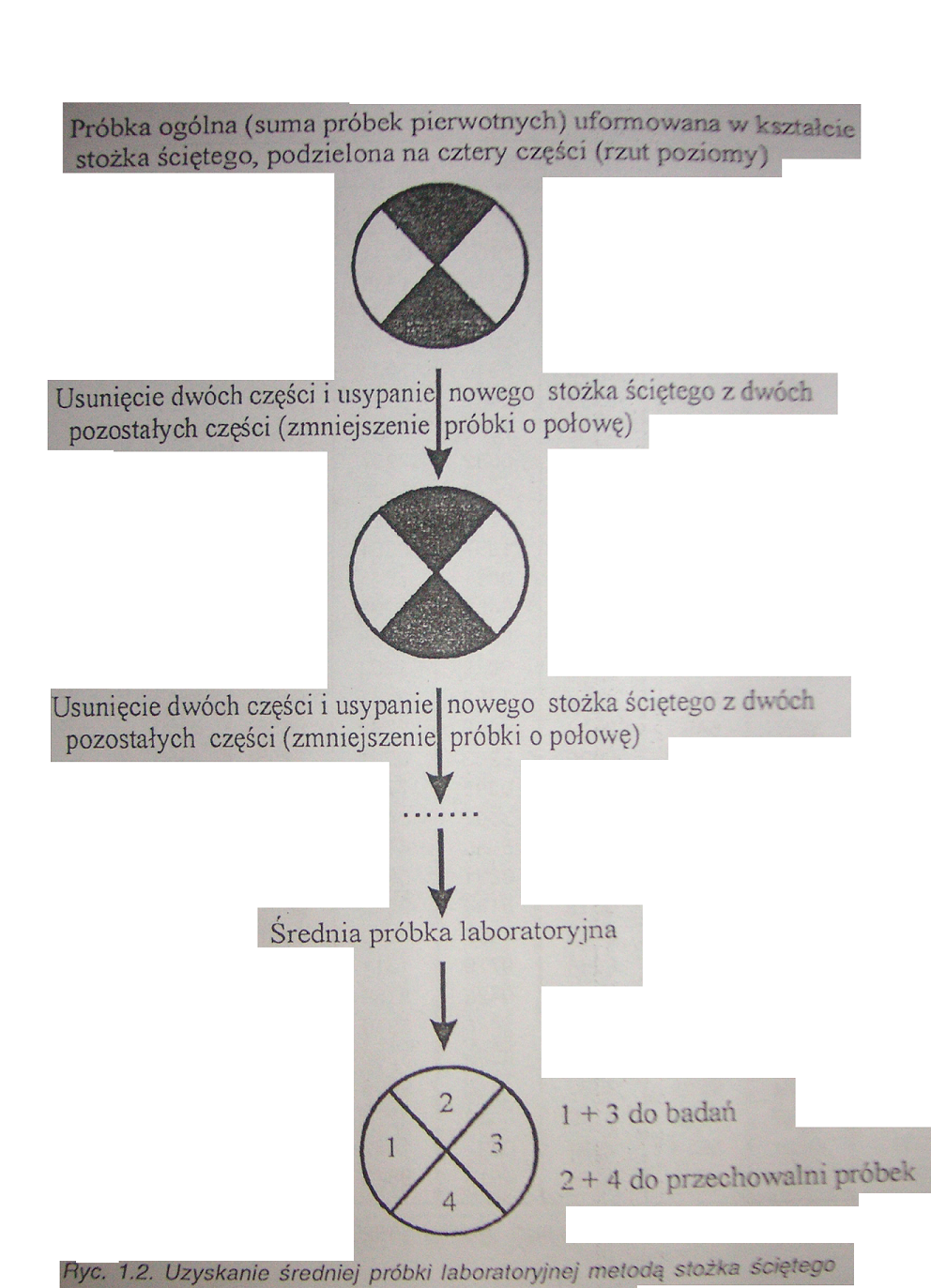
Ogólną próbkę laboratoryjną rozsypuje się na gładką powierzchnię o kształcie prostokąta. Prostokąt dzieli się przekątnymi na 4 części. Próbki z przeciwległych trójkątów się odrzuca, a z pozostałych po wymieszani tworzy się następny mniejszy prostokąt. Czynność powtarzamy, aż do uzyskania odpowiedniej ilości materiału potrzebnej do utworzenia średniej próbki laboratoryjnej
3. Metoda stożka ściętego
4. Metoda precyzyjna
Metoda jest precyzyjna jeżeli w tej samej próbce (lub w próbkach o identycznym składzie chemicznym podczas wielokrotnego oznaczania zawartości określonego składnika tą samą metodą) fluktuacje wyników: x1, x2, …, xn dookoła średniej arytmetycznej są niewielkie (wyniki w niewielkim stopniu różnią się od siebie).
5. Deflegmator
Jest to nasadka a kolbę destylacyjną, zawracająca pewną frakcję oparów do kolby destylacyjnej.
6. Instron to tekturometr
7. Mytron to wagosuszarka
Analiza sensoryczna
1. Analiza sensoryczna
Nauka o pomiarze i ocenie właściwości produktu za pomocą jednego lub kilku zmysłów stosowanych jako aparat pomiarowy, przy zachowaniu odpowiednich warunków oceny oraz wymagań dotyczących przeprowadzających ją osób oraz przy użyciu metod adekwatnych do zadania stawianego ocenie. Zgodnie z definicją, aparatem pomiarowym w analizie sensorycznej są zmysły ludzkie (wzrok, węch, słuch, smak, czucie)
2. Próg wyczuwalności
Minimalne natężenie bodźca sensorycznego, potrzebne do wywołania wrażenia, które może nie być zidentyfikowane.
3. Próg rozpoznania
Minimalne natężenie bodźca sensorycznego pozwalające na rozpoznanie odbieranego wrażenia.
4. Próg różnicy
Wartość najmniejszej wyczuwalnej różnicy w fizycznym natężeniu bodźca.
5. Próg krańcowy
Minimalna wartość bodźca sensorycznego o dużej intensywności, powyżej której dalszy przyrost bodźca nie wywołuje przyrostu intensywności wrażenia.
6. Aromat
Charakterystyczny zapach rodzimy zachowany z surowca wyjściowego, np. aromat świeżego owocu, mleka, soku owocowego, przypraw.
7.Cierpkość
Ściągające doustne wrażenie czuciowe spowodowane kurczeniem się, ściąganiem i marszczeniem powierzchni wewnętrznej jamy ustnej.
8. Smakowitość
Kompleksowe wrażenie smakowo-zapachowo-czuciowe odbierane przez oceniającego przy rozprowadzaniu produktu spożywczego w jamie ustnej.
9. Percepcja
Postrzeganie efektów pobudzenie przez jeden bodziec sensoryczny lub kilka z nich
10. Do jakich metod zaliczamy metody: duo-trio, trójkątową, parzystą?
Do prób na określanie wartości smakowych progów różnicy.
Do różnicowych metod na wykrywanie różnic jakościowych
11. Metoda stałego bodźca
Próbki są prezentowane oceniającym w losowej kolejności, w układach parzystych, przy czym w każdej parze, jedna próbka jest zawsze standardem, a druga zaś jest słabsza lub silniejsza od standardu. Oceniający ma za zadanie określić, która próbka w każdej parze jest bardziej intensywna. Wyniki uzyskane dla poszczególnych par, po zsumowaniu mogą być przedstawione w postaci wykresu częstotliwości odpowiedzi „próbka badana intensywniejsza od standardu” od stężenie bodźca. Zakres stężeń leżący pomiędzy 25%, a 75% pozytywnych odpowiedzi reprezentuje podwójną wartość progu różnicy.
Oznaczanie gęstości i lepkości
1. Gęstość względna
Stosunek gęstości bezwzględnej danego ciała do gęstości bezwzględnej innego ciała (najczęściej wody), przyjętego jako wzorzec:
d = mxt / mwt
gdzie: mxt, mwt - masa ciała i wody w danej temperaturze
2. Aerometr Baumé
Stosowany m.in. do pomiarów gęstości syropu ziemniaczanego, melasy, roztworów ługu sodowego, kwasu siarkowego (VI), chlorku sodu. Stopnie Baumé odpowiadają w przybliżeniu zawartości NaCl w roztworach wodnych.
d = 144,3 / (144,3 - n)
n - wskazanie aerometru [°Bé]
3. Oznaczanie gęstości laktodensymetrem
Służy do oznaczania gęstości mleka.
d = 1 + °L/1000
4. Aerometr(alkoholomierz) Trallesa [°Tr]
Wskazuje zawartość etanolu w % obj. [cm3/100cm3]
5. Oznaczanie piknometrycznego powinno być:
Wykonywane w stałej temperaturze
6. Pomiar lepkości wiskozymetrem Höpplera
Do rurki pomiarowej wlewa się badaną ciecz i po ustaleniu się temperatury wkłada się kulkę w taki sposób, aby nie wprowadzić banieczek powietrza. Następnie bada się jej czas opadania pomiędzy pierścieniami zaznaczonymi na rurce. Kulka, opadająca, porywa ze sobą warstewki cieczy w wąskiej szczelinie, co wytwarza opór lepki hamujący ruch kulki. Na kulkę działają trzy siły: jej ciężar, parcie cieczy i siły tarcia wewnętrznego. Lepkość dynamiczna oznaczana na podstawie pomiaru czasu opadania kulki jest obliczana na podstawie prawa Stokesa.
η = k · t · (dk - dc)
k - stała kulki
dk - gęstość kulki
dc - gęstość badanej cieczy
7. Pomiar lepkości wiskozymetrem Ostwalda
W stałej temperaturze badamy czas opadania pomiędzy dwiema kreskami w wiskozymetrze dla wody i dla badanej cieczy i znając lepkość wody w danej temperaturze obliczamy lepkość badanej cieczy.
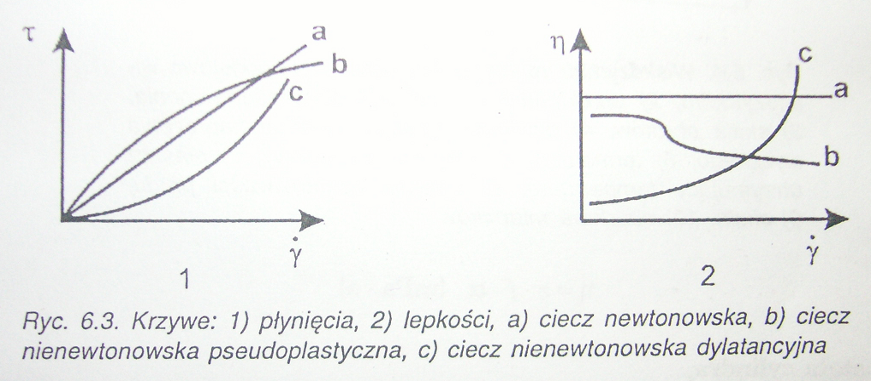
8. Krzywe płynięcia i lepkości
Oznaczanie kwasowości
1. Kwasowość lotna
Zawartość w produktach spożywczych kwasów(lotnych) ulegających odparowaniu z parą wodną.
2. Aparat do destylacji z parą wodną
3. Destylacja z parą wodną
Stosowana jest do oznaczanie kwasowości lotnej w winie.
4. Metoda miareczkowa (potencjalna)
Jest miarą zawartości substancji chemicznych o charakterze kwaśnym występujących w badanych produktach spożywczych, a w szczególności kwasów organicznych, nieorganicznych i ich soli ulegających hydrolizie kwasowej. Ten rodzaj kwasowości oznacza się za pomocą miareczkowania alkacymetrycznego z zastosowaniem odpowiednich wskaźników alkacymetrycznych (klasyczne miareczkowanie) lub miareczkowania alkacymetrycznego z pehametryczną detekcją punktu końcowego (miareczkowanie potencjometryczne).
5. Stopnie Soxhleta
Liczba cm3 0,25M roztworu wodorotlenku sodu potrzebna do zobojętnienia 50cm3 mleka, stosowane w przemyśle mleczarskim.
Oznaczanie zawartości wody
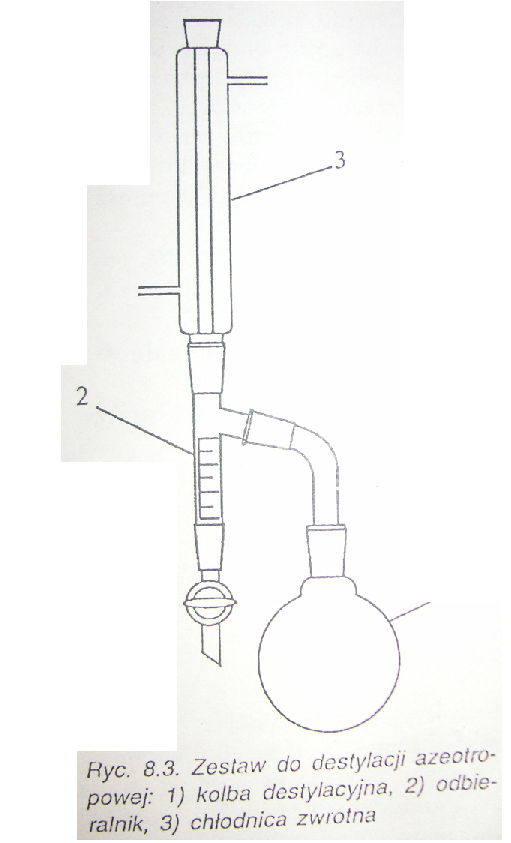
1. Destylacja azeotropowa
Polega na oddestylowaniu wody z badanej próbki na drodze destylacji z cieczami azeotropującymi, nie mieszającymi się z wodą. Najczęściej stosuje się ciecze azeotropujące nierozpuszczalne w wodzie, o gęstości mniejszej od wody i temperaturze wrzenia wyższej niż 100°C (toluen, ksylen), które po skropleniu zbierają się nad warstwą wody w kalibrowanej części odbieralnik. Rozpuszczalniki powinny być wysycane wodą. Istotna jest czystość aparatów, a przed oznaczeniem należy popłukać aparat alkoholem i eterem.
2. Oznaczanie wilgotności miękiszu chleba metodą odwoławczą
Ważymy puste i wysuszone naczyńko wagowe.
Do wysuszonego do stałej masy naczyńka wagowego odważamy miękisz chleba. Wstawiamy do suszarki o temp. 130°C otwarte naczyńko. Ważymy naczyńko po wysuszeniu.
X = 100*(b - c)/(b - a)
gdzie:
X - % zawartość wody
a - masa naczyńka
b - masa naczyńka z próbką przed suszeniem
c - masa naczyńka z próbką po suszeniu
3. Sucha substancja (masa)
Pozostałość po usunięciu z produktu wody właściwą metodą analityczną.Oznaczanie zawartości ekstraktu
1. Ekstrakt
Suma substancji rozpuszczonych w wodzie i nielotnych z parą wodną. Określa się go również jako suchą substancję rozpuszczalną w wodzie.
2. Ekstrakt rzeczywisty
Jest to suma składników rozpuszczonych w wodzie mierzona po oddestylowaniu związków lotnych i uzupełnieniu próbki wodą do pierwotnej objętości.
3. Ekstrakt pozorny
Ekstrakt roztworów oznaczony jedną z metod (areometryczną, refraktometryczną, densymetryczną) bez usunięcia z próbki związków lotnych (głównie etanolu). Zawarty w próbce alkohol (i inne substancje lotne) powodują błędy wskutek rozrzedzenia środowiska lub zmiany współczynnika refrakcji.
4. Ekstrakt bezcukrowy
Jest to różnica pomiędzy zawartością ekstraktu ogólnego, a sumą cukrów redukujących oraz sacharozy zawartymi w produkcie.
Oznaczanie zawartości białka
1. Metoda Kjeldahla
Składa się z 3 etapów:
- mineralizacji próbki (stężony kwas siarkowy (VI) w temperaturze wrzenia tego kwasu),
- oddestylowaniu amoniaku (w aparacie Parnasa-Wagnera, dodając nadmiar NaOH, a w odbieralniku nadmiar H2SO4 i wskaźnik Taschiro),
- miareczkowanie mianowanym roztworem NaOH w obecności wskaźnika Taschiro .
2. Na jakiej zasadzie oblicza się zaw. białka w met. Kjeldahla
Ilość zużytego do miareczkowania kwasu siarkowego (VI) odpowiada konkretnej ilości azotu. Następnie zawartość białka liczymy przemnażając ilość azotu przez mnożnik białkowy
3. Do mineralizacji próbki w metodzie Kjeldahla
Stosuje się stężony kwas siarkowy (VI) w temperaturze wrzenia tego kwasu.
4. Ile wynosi mnożnik białkowy i w jakiej metodzie
Wynosi 6,25. Stosuje się go w metodach pośrednich: Dumasa i Kjeldahla.
5. Aparat Parnasa-Wagnera
6. Elektroforeza
Jest zjawiskiem ruchu cząsteczek obdarzonych ładunkiem elektrycznym (jonów) w polu elektrycznym o określonym gradiencie potencjału względem nieruchomego ośrodka dyspersyjnego. Podstawą metod elektroforetycznych są różnice w migracji cząstek koloidalnych w polu elektrycznym. Oznaczanie zawartości tłuszczów
1. Metoda Gerbera
Należy do metod objętościowych. Polega na rozpuszczeniu otoczek białkowych emulsji tłuszczu i wydzieleniu tłuszczu w przyrządzie zwanym tłuszczomierzem. Otrzymanie tłuszczu w postaci klarownej ułatwia dodatek alkoholu izoamylowego. Wskutek wirowania następuje oddzielenie fazy tłuszczowej od rozpuszczonych w kwasie siarkowym cząstek mleka. Po odwirowaniu zawartość tłuszczu w % odczytuje się na skali tłuszczomierza.
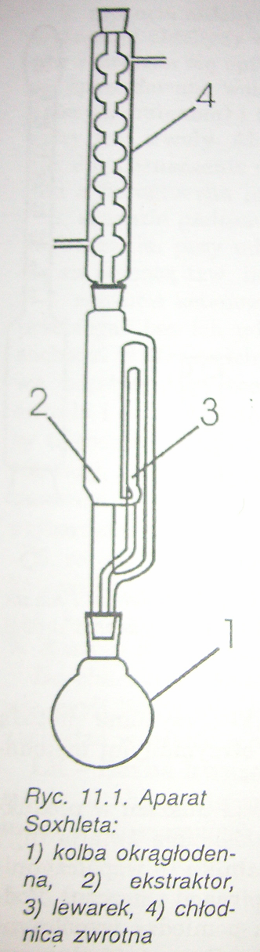
2. Metoda Soxhleta
Polega na wyekstrahowaniu substancji tłuszczowych z rozdrobnionego
i uprzednio wysuszonego produktu za pomocą eteru etylowego, uwolnionego
od nadtlenków i pozbawionego wody, lub innego rozpuszczalnika organicznego.
Ekstrakcję przeprowadza się w aparacie Soxhleta.
3. Liczba estrowa
Zależy od długości łańcuchów kwasów tłuszczowych wchodzących w
skład glicerydów danego tłuszczu; jest tym wyższa, im łańcuchy są krótsze;
wyraża się ją liczbą mg KOH potrzebną do zmydlenia estrów zawartych w
1g badanego produktu. Oblicza się ją z różnicy liczby zmydlenia i kwasowej.
4. Liczba jodowa
Jest miarą zawartości związków nienasyconych; określa ją liczba
gramową związanego chlorowca w przeliczenia na jod, którą przyłącza w
określonych warunkach 100g badanego produktu.
5. Liczba kwasowa
Określa ilość wolnych kwasów tłuszczowych; wyraża się ją liczbą mg
KOH potrzebną do zobojętnienia kwasów tłuszczowych zawartych w 1g
badanego tłuszczu.
6. Liczba zmydlania
Daje informacje o średniej długości łańcucha węglowego kwasów
tłuszczowych; jest to liczba mg KOH potrzebna do zmydlenia wolnych
kwasów i estrów zawartych w 1g badanej substancji.
7. Liczba Polenskego
Wskazuje na zawartość w tłuszczu lotnych kwasów tłuszczowych, nierozpuszczalnych w wodzie; wyraża się ją liczbą cm3 0,1M NaOH potrzebną do zobojętnienia nierozpuszczalnych kwasów tłuszczowych w 110 cm3 destylatu uzyskanego z 5g tłuszczu w ściśle określonych warunkach.
8. Próba Kreisa
Służy do wykrywania aldehydu epihydrynowego. Polega na kondensacji dwóch cząsteczek floroglucyny lub rezorcyny z jedną cząsteczką aldehydu epihydrynowego. Intensywność barwy jest proporcjonalna do zawartości aldehydu w badanej próbce, tak więc można jego zawartość oznaczyć kolorymetrycznie (przez porównanie z wzorcami) lub spektrofotometrycznie.
Oznaczanie zawartości cukrów
1. Cukier inwertowany
Sacharoza nie wykazuje mutarotacji i nie ma właściwości redukujących. Pod wpływem kwasów lub enzymu INWERTAZY sacharoza ulega hydrolizie na glukozę i fruktozę. Mieszaniną równych ilości glukozy i fruktozy nazywa się cukrem inwertowanym lub inwertem. Nazwa „cukier inwertowany” wywodzi się od zjawiska „ inwersji” (hydrolizy sacharozy). Wodny roztwór sacharozy skręca płaszczyznę światła w prawo a roztwór cukru inwertowanego w lewo, zgodnie z poniższym schematem:
Tak więc po hydrolizie sacharozy zachodzi zmiana skręcalności kąta płaszczyzny światła spolaryzowanego.
2.Metoda Bertranda
Polega na przeprowadzeniu w roztworze alkalicznym redukcji soli miedziowych cukrem i oznaczaniu miedzi z wydzielonego tlenku miedzi (I).
Oznaczanie miedzi polega na ultenieniu tlenku miedzi(I) w wyniku redukcji soli żelaza (III) do żelaza (II) i na oznaczaniu soli żelaza (II) manganometrycznie. W analizie cukrów redukujących metodą Bertranda badany roztwór gotuje się z mieszaniną roztworów Bertranda I i II.
CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
HO-CH-COONa O - CH - COONa
Cu(OH)2 + | → Cu | + 2 H2O
HO-CH-COOK O - CH - COOK
O - CH - COONa HO-CH-COONa
R-CHO + Cu | + 2 H2O → R-COOH + Cu2O + 2 |
O - CH - COOK HO-CH-COOK
Cu2O + Fe2(SO4)3 + H2SO4 → 2CuSO4 + H2O + 2FeSO4
2 KMnO4 + 10 FeSO4 + 8 H2SO4 → K2SO4 + 5Fe2(SO4)3 + 8H2O + 2MnSO4
3. Bertrand III
50g siarczanu (VI) żelaza rozpuścić na gorąco w 500cm3 wody destylowanej w kolbie miarowej na 1000cm3 z dodatkiem 200g kwasu siarkowego (VI), nie dopuszczając do wrzenia. Po całkowitym rozpuszczeniu, ostudzić i dolać wody destylowanej do kreski.
4. Metoda Luffa-Schoorla
Wykorzystuje właściwości redukujące cukrów. Stosuje się węglan sodu i kwas cytrynowy. Ilość zredukowanej miedzi oznacza się pośrednio za pomocą metod jodometrycznych, a zawartość cukrów redukujących odczytuje się z tablic na podstawie ilości tiosiarczanu (VI) sodu zużytego do miareczkowania.
5. Metoda Lane-Enyona
Polega na redukcji na gorąco alkalicznego roztworu soli miedzi(II) przez bezpośrednie miareczkowanie roztworem cukrów redukujących w obecności błękitu metylenowego jako wskaźnika. Błękit metylenowy ulega odbarwieniu w środowisku zasadowym dopiero po całkowitym zredukowaniu miedzi do tlenku, którego osad nadaje roztworami zabarwienie czerwone. Bardzo ważne jest utrzymanie mieszaniny w stanie wrzenia podczas miareczkowania.
CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
HO-CH-COONa O - CH - COONa
Cu(OH)2 + | → Cu | + 2 H2O
HO-CH-COOK O - CH - COOK
O - CH - COONa HO-CH-COONa
R-CHO + Cu | + 2 H2O → R-COOH + Cu2O + 2 |
O - CH - COOK HO-CH-COOK
Zawartość cukrów redukujących odczytuje się z tablic.
6. Metoda Munsona-Walkera
Jest rozwinięciem metody Lane-Enyona, a modyfikacja polega na oznaczaniu wytrąconego i przesączonego osadu Cu2O przez miareczkowanie managanometrzyne jodometryczne.
7. Do usuwania substancji przeszkadzających w oznaczaniu stosuje się soli metali ciężkich takich jak octan rtęci(II).
8. Cukromierze
Aerometr Ballinga i Brixa - wskazuje zawartość sacharozy w roztworach wodnych w procentach wagowychOznaczanie zawartości polisacharydów
1. Celuloza
Polisacharyd, o cząsteczkac h złożonych z kilkunastu do kilkuset tysięcy jednostek glukozy połączonych wiązaniami β-1,4-glikozydowymi.
2. Oznaczanie zawartości skrobi metodą polarymetryczną
Wykorzystuje zdolność skręcania płaszczyzny światła spolaryzowanego przez roztwory. Roztwór skrobi skręca płaszczyznę polaryzacji zgodnie ze wzorem Biota:
C = 100 · α / ([α]D20· l)
α - kąt skręcania płaszczyzny polaryzacji światła
[α]D20 - skręcalność właściwa skrobi
l - grubość warstwy roztworu, czyli długość rurki polarymetrycznej
3. Jaka substancja najlepiej rozpuszcza skrobię
Roztwory Carreza I i II (?)
4. Metoda Scharrera-Kürschnera
Polega na gotowaniu próbki, w której ma być oznaczony błonnik, z mieszaniną kwasów: octowego, azotowego(V) i trichlorooctowego. Uzyskany osad przemywa się na sączku, suszy w temperaturze 105°C do stałej masy i waży. Następnie sączek z osadem spopiela się w temperaturze 550°C i waży. Oblicza się zawartość błonnika bezpopiołowego.
5. Pektyny
Rozpuszczalne w wodzie estry kwasu poligalakturonowego częściowo zestryfikowane alkoholem metylowym. Oznaczanie zawartości alkoholu
1. Aerometr (alkoholomierz) Trallesa
Stosowany w destylatach zawierających ponad 1% etanolu,
Wskazuje zawartość etanolu w % obj. [cm3/100cm3]
2. Metoda chemiczna oznaczania zawartości alkoholu (<1%)
( w produktach o niewielkiej zawartości etanolu - do 1 %) polega na utlenieniu alkoholu dichromianem (VI) potasu lub manganianem (VII) potasu. Jeżeli substancją utleniającą jest K2Cr2O7, alkohol etylowy utlenia się do kwasu octowego w środowisku kwaśnym, zgodnie z równaniem reakcji:
3 CH2OH5 + 2Cr2O72 - + 16H + = 3 CH3COOH + 4Cr 3+ + 11H2O
Nadmiar dichromianu (VI) potasu oznacza się jodometrycznie:
Cr2O7 2 - + 6I - + 14H + = 2Cr 3+ + 3I2 + 7H2O
a wydzielony jod odmiareczkowuje się mianowanym roztworem tiosiarczanu (VI) sodu:
I2 + 2S2O3 2 - = 2 I - +S4O6 2 -
3. Oznaczanie zawartości alkoholu w piwie
Refraktometrycznie
4. Zasada refraktometrycznego oznaczania zawartości alkoholu
Napełniamy badaną cieczą naczyńko refraktometryczne, zanurzamy pryzmat refraktometru w badanej cieczy. Nastawiamy lusterkiem największy kontrast pól ciemnego i jasnego. Odczytać wskazania refraktometru. Zawartość alkoholu jest zależna od gęstości badanej cieczy i odczytu z refraktometru.
5. Sól Mohra - oznaczanie alkoholi
Nadmiar chromianu (VI) potasu można również odmiareczkować roztworem siarczanu (VI) żelaza (II)-amonu (sól Mohra) w obecności wskaźnika ferro-fenantroliny lub difenyloaminy:
K2Cr2O7 + 6 Fe(NH4)2(SO4)2 + 8 H2SO4 →
→ 5 Fe2(SO4)3 + 2MnSO4 + 10 (NH4)SO4 + K2SO4 + 8 H2O
Nadmiar soli Mohra odmiareczkowuje się manganometrycznie w środowisku kwaśnym:
2KMnO4 + 10 Fe(NH4)2(SO4)2 + 8 H2SO4 →
→ 5 Fe2(SO4)3 + 2 MnSO4 + 10 (NH4)SO4 + K2SO4 + 8 H2OOznaczanie zawartości popiołu i składników mineralnych
1. Konduktometria
Metoda analityczna polegająca na pomiarze przewodności elektrolitycznej roztworu między dwiema identycznymi elektrodami obojętnymi (nie reagującymi ze składnikami roztworu), do których jest przykładany prąd zmienny o częstotliwości do 10kHz.
2. Absorpcyjna spektrometria atomowa
Wykorzystuje zjawisko absorpcji promieniowania elektromagnetycznego przez wolne atomy danej substancji. Metoda ta charakteryzuje się dużą czułością, selektywnością, odtwarzalnością oznaczeń i niską granicą wykrywalności.
3. Oznaczanie chlorków
można przeprowadzić za pomocą:
- miareczkowania merkurymetrycznego
- metody Mohra
- metody Volharda
- metody potencjonometrycznej
- metody spektrofotometrycznej
- metody analizy przepływowo-wstrzkowej
- metody nefelometrycznej
4. Miareczkowanie merkurometryczne
Azotanem (V) rtęci (II) stosowane coraz rzadziej ze względu na toksyczność związków rtęci: 2Cl- + Hg2+ → HgCl↓
5. Metoda Mohra
Polega na miareczkowaniu roztworu zawierającego jony chlorkowe mianowanym roztworem azotanu(V) srebra (miareczkowanie argentometryczne) wobec jonów chromu (VI). Podczas miareczkowania jako pierwszy wytrąca się chlorek srebra, a następnie chromian (VI) srebra, który powoduje brunatnoczerwone zabarwienie roztworu:
Cl- + Ag+ → AgCl↓
CrO42- + 2 Ag+ → Ag2CrO4↓
Można stosować do produktów bezbarwnych lub słabo zabarwionych w pH od 6 do 10.
6. Oznaczanie wapnia
- miareczkowanie kompleksometryczne
- metoda manganometryczna
- metoda wagowa
7. Klarowanie roztworu
Roztwór przed oznaczaniem zawartości chlorków poddaje się działaniu roztworom Carreza I i II.
8. Metoda kompleksometryczna (Ca)
Polega na reakcji wapnia z EDTA wobec czerni eriochromowej T lub mureksydu jako wskaźnika.
9. Metoda miareczkowania manganometrycznego (Ca)
Polega na przeprowadzeniu wapnia w sól rozpuszczalną poprzez mineralizację. Następnie próbkę poddaje się działaniu kwasu szczawiowego lub szczawianu amonu, co powoduje wytworzenie się szczawianu wapnia. Związek ten pod wpływem kwasu siarkowego(VI) rozkłada się z wydzieleniem kwasu szczawiowego, który odmiareczkowuje się roztworem manganianu (VII) potasu:
2 KMnO4 + 5 C2O4Ca + 8 H2SO4 →
→ K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O + 5 CaSO4
Oznaczanie witamin
1. Witamina C i jej formy aktywne
- kwas L-aksorbinowy
- kwas L-dehydroaskorbinowy
- askorbigen
2. Witamina C utlenianie
Kwas L-aksorbinowy kwas 2,3-diketo-L-gulonowy
Kwas L-dehydroaskorbinowy kwas L-treonowy i szczawiowy
3. Po co dodaje się HgCl przy oznaczaniu witaminy C?
W celu strącenia nadmiaru siarkowodoru stosowanego do redukcji kwasu
L-dehydroaskorbinowego do kwasu L-askorbinowego.
4. Które witaminy możemy oznaczyć fluoroscencyjnie
- witaminy A, B1, B2, B6
5. Podział witamin
- rozpuszczalne w wodzie: B, C, PP
- rozpuszczalne w tłuszczach: A, D, E, K
6. Tiamina wit.B1
7. Ryboflawina wit.B2
8. Niacyna wit.B3
9. Kobalamina wit.B12
Oznaczanie substancji konserwujących
Kwas sorbowy i jego sole hamują rozwój pleśli i drożdży w pH 3-6, natomiast wykazują ograniczone działanie w stosunku do bakterii, szczególnie bakterii kwasu mlekowego, co sprawia, że kwas sorbowy jest bardzo użyteczny przy produkcji serów. Stosowany również w napojach mlecznych, sosach sałatkowych, pastach, margarynach, koncentraty zup, sałatki owocowe, galaretki, owoce kandyzowane, słodycze, nadzienia cukiernicze, napoje bezalkoholowe, wina.
1
Wyszukiwarka
Podobne podstrony:
Gewert Skoczylas Analiza matematyczna 2 Kolokwia i egzaminy
Analiza instrumetalna pytaia egzamin (2)
Analiza instrumetalna pytaia egzamin
analiza funkcjonalana kolokwia i egzaminy
KONWERSATORIUM- pytania, Analiza finansowa (ekonomiczna), Analiza finansowa (ekonomiczna) + Egzaminy
Analiza instrumentalna.lab, Egzamin
analiza systemow informatycznych, Egzamin z PSI, Egzamin składa się z 30 pytań i modelu UML do zapro
M Gewert Z Skoczylas Analiza Matematyczna 1 Kolokwia i Egzaminy
analiza fin tematy egzamin
Analiza zywnosci sciaga, Dietetyka 2012,2013, Analiza jakosci zywnosci, egzamin
Gewert Skoczylas Analiza matematyczna 2 Kolokwia i egzaminy
oznaczanie żelaza, Egzamin zawodowy
Analiza finansowa - pytania z egzaminu, Finanse i rachunkowość ue katowice hasło 1234, analiza finan
23c. Prozodia wiersza. Parodia a satyra, poetyka z el. teorii literatury, analiza dzieła literackieg
analiza2poprawa, Informatyka i Ekonometria SGGW, Semestr 2, Analiza matematyczna, kolokwia egzaminy,
Zakres materiału na egz sem I, AGH Matematyka Stosowana (WMS), Analiza matematyczna, Sem I, egzamin
Analiza finansowa-ściąga, Egzamin zawodowy Technik Ekonomista
analiza funkcjonalana, kolokwia i egzaminy
więcej podobnych podstron