Proporcje kwasu i wody w kolbach
Kolba 1: 10ml kwasu benzoesowego ( 0,026 mol/dm3) i 11 mol wody destylowanej
Kolba 2 : 3,5ml kwasu i 16ml wody
Kolba 3 : 16,5ml kwasu i 3ml wody
Kolba 4 : 7ml kwasu i 12ml wody
Kolba 5 : 13ml kwasu i 6ml wody
Do każdej kolby dolano 5ml toluenu, po czym zawartość koleb została energicznie wymieszana przez ok. 6 min. Po czasie 10 min z dolnej warstwy zawartości kolby (wodny roztwór kwasu benzoesowego ) do osobnych koleb zostało pobrane po 5 ml roztworu. Do każdej nowej kolby dodano po 2 krople fenoloftaleiny i miareczkowano zasada sodową o mianie 0,005 mol/dm3, aż do pojawienia się różowego zabarwienia.
Sposób obliczeń C0w ( stężenie roztworu wodnego przed dodaniem toluenu)
Mamy 20ml roztworu, Ck - stężenie molowe kwasu
Ck*Vk=Cw0*VR
VR - objętość roztworu
Vk -objętość kwasu
Nr kolby |
obliczenia |
||
1 |
0,026*10= |
Cw0 *21 |
Cw0=0,0124 |
2 |
0,026*3,5= |
Cw0 *19,5 |
Cw0=0,0046 |
3 |
0,026*16,5= |
Cw0 *19,5 |
Cw0=0,022 |
4 |
0,026*7= |
Cw0 *19, |
Cw0=0,0096 |
5 |
0,026*13= |
Cw0 *19 |
Cw0=0,0177 |
Ilość zasady użyta na miareczkowanie do chwili pojawienia się różowego zabarwienia
nr kolby |
objętośc NaOH [cm3] |
1 |
18 |
2 |
7 |
3 |
19 |
4 |
14 |
5 |
13,5 |
Sposób obliczeń Cw- stężenie roztworu kwasu po dodaniu toluenu
Cz- stężenie molowe zasady uzytej do miareczkowania = 0,005 mol/ dm3
Vz- objętość zasady miareczkowanej
VR- objętość roztworu wodnego (kwas + woda)
CR*VR= Cz*V2 CR=Cw
nr kolby |
obliczenia |
CR=Cw |
1 |
CR*21=0,005*18 |
CR=0,0043 |
2 |
CR*19,5=0,005*7 |
CR=0,0018 |
3 |
CR*19,5=0,005*19 |
CR=0,0049 |
4 |
CR*19=0,005*14 |
CR=0,0037 |
5 |
CR*19=0,005*13,5 |
CR=0,0036 |
Sposób obliczenia Corg (stężenie kwasu w warstwie organicznej)
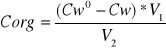
V1= 5ml - objętość roztworu kwasu beztlenowego
V2= 5ml - bjetosc dodanego toluenu
Corg= Cw0-Cw , bo V1=V2
nr kolby |
obliczenia |
1 |
Corg= 0,0124-0,0043=0,0081 |
2 |
Corg= 0,0046-0,0018=0,0028 |
3 |
Corg=0,022-0,0049=0,0171 |
4 |
Corg=0,0096-0,0037=0,0059 |
5 |
Corg=0,0177-0,0036=0,0141 |
Wyznaczanie stałych n i K metoda małych kwadratów
n- stała uwzględniająca asocjację lub dysocjacje składnika ulegającego podziałowi, jest to również współczynnik kierunkowy prostej przedstawiającej wykres zależności lg Cw= f(lgCorg)
K-stała podziału
lgK- wyraz wolny rzędna zerowa
![]()
Po zlogarytmowaniu
lgCw= lgK+nlgCorg
przyjmując Y=lgCw i X=lgCorg otrzymuje równanie liniowe
Y=ax+b , a=n , b=lgK
Z metody najmniejszych kwadratów
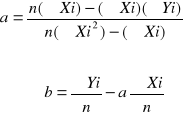
n= ilośc pomiarów n=5
do obliczeń potrzebne sz wartości
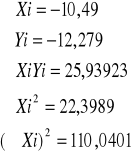
![]()
lgK= -1,501
K=10-1,501
K=0,0315
n=0,4551
Lp |
Cw0 mol/dm3 |
cw mlo/dm3 |
Corg mol/dm3 |
lg Cw |
log Corg |
1 |
0,0124 |
0,0043 |
0,0081 |
-2,36 |
-2,09 |
2 |
0,0046 |
0,0018 |
0,0028 |
-2,74 |
-2,55 |
3 |
0,022 |
0,0049 |
0,0171 |
-2,309 |
-1,77 |
4 |
0,0096 |
0,0037 |
0,0059 |
-2,43 |
-2,23 |
5 |
0,0177 |
0,0036 |
0,0141 |
-2,44 |
-1,85 |
wykres zależności lg Cw= f( lg Corg)
Wnioski:
Po wlaniu toluenu do kolby z wodą obie substancje nie mieszaja się ze soba, toluen ma mniejsza gęstośc i dlatego pływa po powierzchni
Kwas benzoesowy rozpuszcza się zarówno w wodzie jak i w warstwie organicznej (toluenie)
Wykres zależności funkcji lgCw= f(lgCorg) jest nachylony do osi OX mniej wiecej pod kątem 25o, co oznacza że współczynnik kierunkowy prostej jest równy ok. 0,45 co zgadza się z wartością współczynnika kierunkowego n wyliczonego metoda najmniejszych kwadratów (n=0,4551)
Wyszukiwarka
Podobne podstrony:
wste, Szkoła PŁ, chemia fizyczna laborki
CWICZENIE7 (2), Szkoła PŁ, chemia fizyczna laborki
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
więcej podobnych podstron