Edyta Chlewińska
Prawo podziału (Nersta)
TEORIA:
Cel ćwiczenia:Wyznaczenie stałej podziału kwasu benzoesowego pomiędzy dwie nie mieszające się ciecze (np. wodę i toluen).
Faza: jednolita fizycznie i chemicznie czesc układu, odzielona od innych części wyraznie ukształtowana powierzchnia podziału
Składnik: czesc układu złozona z identycznych rodzajów atomów połączonych ze sobą w takich samych stosunkach ilościowych
Liczba stopni swobody: liczba parametrów układu, które można zamieniać nie naruszając równowagi fazowej. Parametrami sa: ciśnienie temperatura i masa
Prawo podziału: stosuje się do układu zawierającegodwie nie mieszające się ciecze Ai B oraz trzeci składnik C (ciało stałe lub ciecz ) rozpuszczalny w obu cieczach. W wyniku rozpuszczenia rozpuszczenia składnika C powstaja dwa roztwory dwuskładnikowe, a mianowicie Cw w A i Cw w B o stężeniach molowych CA i CB. W warunkach izobaryczno-izotermicznych (p,T= cons) stężenie to psełnia tzw prawo podziału:
![]()
![]()
Do opisu równowagi w układzie trójskładnikowych ciekłym w warunkach p,T = cons stosuje się trójkąt Gibbsa. Jest to trójkąt równoboczny. Równowaga fazowa w układzie trzech cieczy występuje wówczas,gdy przynajmniej dwie maja ograniczoną mieszalnośc
W celu wyznaczenia stałych K i n należy znac stężenia CA i CB składnika C w obu fazach pozostających ze sobą w równowadze. Sporządza się roztwór składnika C w cieczy A o stężeniu CAo. Nastpnie do tego roztworu o objtođci V 1( w cm) dodaje się ciecz B o objętości V2 (w cm3). Po wstrzaśniejciu i rozdzieleniu się faz wyznacza się stężenie CA składnika C w cieczy A. stężenie tego składnika w cieczy B jest równe
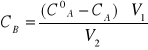
Reguła faz Gibbsa- prawo równowagi fazowej
Równowaga fazowa- współistnienie ze sobą dwóch lub wiecej faz o stałych
![]()
Z-liczba stopni swobody
liczba składników niezależnych
liczba faz
1
1
Wyszukiwarka
Podobne podstrony:
Proporcje kwasu i wody w kolbach, Szkoła PŁ, chemia fizyczna laborki
CWICZENIE7 (2), Szkoła PŁ, chemia fizyczna laborki
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
więcej podobnych podstron