Marcin Zieliński 25.II.2003
opiekun: prof. R. Wódzki
Ćwiczenie nr 9
Wyznaczanie stałej kalorymetru
i ciepła rozcieńczania.
Gdy mamy do czynienia z pomiarem temperatury na pewno będzie on powiązany z pomiarem ilości ciepła w kalorymetrze. Dla przemian izotermicznych stosujemy termin kalorymetr zaś dla przemian izochorycznych stosujemy tzw. „bomby kalorymetryczne”. Standardowy kalorymetr składa się z płaszczu izolacyjnego, naczynia kalorymetrycznego, termometru, mieszadła, naczyńka z reagentem oraz z innych elementów, które będą ściśle związane z charakterem danego procesu.
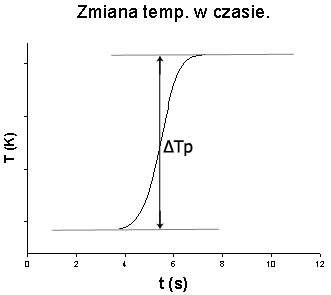
Wykres obok przedstawia typową zależność zmiany temperatury w kalorymetrze w czasie.
W ćwiczeniu tym pomiar temperatury odbywa się za pomocą termistora (termometr oporowy, półprzewodnikowy), mierzącego zmianę oporu. Zależność oporności termistora od temperatury jest wykładnicza, dlatego też wyraża się ją za pomocą wzoru:
; gdzie k - stała zależna od użytego termistora, R2 - opór w momencie zakończenia danego okresu pomiarowego (wstępnego, głównego, końcowego), R1 - opór w momencie rozpoczęcia danego okresu pomiarowego.
Aby otrzymać rzeczywistą temperaturę trzeba wziąć pod uwagę tzw. poprawkę na promieniowanie, którą wylicza się ze wzoru:
; gdzie ΔTw, ΔTk - zmiany temperatur w okresach odpowiednio wstępnym i końcowym, l,m,n - są to liczby odcinków półminutowych w wymienionych okresach zaś Δp to poprawka na promieniowanie.
Taką poprawkę dodaje się do otrzymanej wcześniej temperatury.
Wartość stałej kalorymetru wyznacza się doświadczalnie, przeprowadzając w kalorymetrze reakcję o dobrze znanym cieple. Dlatego też w ćwiczeniu tym przeprowadza się reakcje rozcieńczania stężonego kwasu solnego i stężonego kwasu siarkowego i reakcje zobojętniania ich zasadą sodową. Efekty cieplne zobojętniania obu kwasów są dobrze znane i na ich podstawie będzie obliczona stała kalorymetru.
Literatura:
- J. Ceynowa, M. Litowska, R. Nowakowski, J. Ostrowska-Czubeńko
„Podręcznik do ćwiczeń laboratoryjnych z chemii fizycznej” UMK Toruń 1999
str. 18-21
- L. Sobczyk, A. Kisza, K. Gatner, A. Koll „Eksperymentalna chemia fizyczna” PWN
W-wa - 1982 - str. 38-43
Substancje chemiczne:
- stężony kwas solny 0008
- stężony kwas siarkowy 0024
- rozcieńczony roztwór wodorotlenku sodu
- rozcieńczony roztwór kwasu solnego
Oświadczam, że zapoznałem się z kartami charakterystyk w/w substancji i znane mi są właściwości tych substancji, sposoby bezpiecznego postępowania z nimi oraz zasady udzielania pierwszej pomocy w nagłych wypadkach.
Wyszukiwarka
Podobne podstrony:
SI wstep
Zajęcie1 Wstęp
Wstęp do psychopatologii zaburzenia osobowosci materiały
układ naczyniowy wstep
ZMPST Wstep
Dekalog 0 wstęp
1 WSTEP kineza i fizykot (2)
01 AiPP Wstep
wstęp neg
Wyklad I Problemy etyczne Wstep
ochrona srodowiska wstep
Tajemnica ludzkiej psychiki wstep do psychologii
PS 1 Psychologia społeczna wstep
więcej podobnych podstron