Nr ćwiczenia: 11 |
Temat ćwiczenia: |
Ocenia z teorii: |
Nr zespołu: 6 |
Imię i nazwisko: Michał Koczur
|
Ocena z zal. ćwiczenia: |
Data: 02.04.2007 |
wydział: EAIiE rok: I grupa: 2 |
Uwagi: |
I. Cel ćwiczenia
Celem ćwiczenia jest analiza spektralna światła emitowanego przez atomy wodoru, odtworzenie układu stanów energetycznych oraz wyznaczenie energii jonizacji atomu wodoru.
II. Wymagane wiadomości teoretyczne
siatka dyfrakcyjna - jeden z najprostszych przyrządów do przeprowadzania analizy widmowej. Tworzy ją układ równych, równoległych i jednakowo rozmieszczonych szczelin. Jest instrumentem pozwalającym wyznaczyć długość fal świetlnych. Prążki jasne powstają dla kątów αn spełniających warunek:
dsin(αn) = nλ
Widmo spektroskopowe to zarejestrowany obraz promieniowania rozłożony na częstotliwości, długości fali lub energii, które zostało wyemitowane albo weszło w kontakt z analizowaną substancją, przeszło przez nią lub zostało przez nią odbite. Widma są w stanie dostarczyć szeregu cennych informacji o analizowanej substancji. Klasyfikacja widm:
• ze względu na wygląd widma
o widmo ciągłe - ma postać ciągłego obszaru lub szerokich pasów (widmo o składowych, występujących w sposób ciągły wzdłuż skali częstotliwości),
o widmo liniowe - ma postać oddzielnych linii na pasku widmowym; typowo występuje dla atomów gazów rozrzedzonych,
• ze względu na sposób powstania
o widmo emisyjne - powstaje w wyniku emisji promieniowania przez ciało
o absorpcyjne - powstaje w wyniku oddziaływania (przejścia lub odbicia) fali o widmie zazwyczaj ciągłym z substancją.
Seria Balmera - seria widm powstająca w wyniku emisji fotonów przez elektron w atomie wodoru przechodzący z wyższego orbitalu na orbital 2 (seria L). Długości fal tej serii to od 364,60 nm do 656,28 nm. Znajdują się one w bliskim nadfiolecie oraz w zakresie światła widzialnego (bezpośrednio widoczne są linie - czerwona (Hα), niebiesko-zielona (Hβ) i dwie fioletowe (Hγ i Hδ)).
Wzór Rydberga (Rydberga-Ritza) - w fizyce atomowej wzór opisujący wszystkie długości fal w widmie liniowym wodoru (serie widmowe), później rozszerzony też na niektóre serie innych pierwaistków w stanie gazowym.
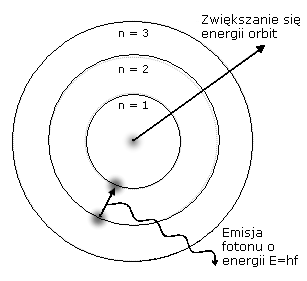
Model atomu Bohra - teoria sformułowana w 1913 roku przez N. Bohra dla atomu wodoru, oparta na planetarnym modelu atomu Rutherforda, zakładającym istnienie dodatnio naładowanego jądra i krążącego wokół niego po orbicie kołowej elektronu, przy czym w celu usunięcia pewnych sprzeczności związanych z tym modelem - wyzyskująca ideę teorii kwantów Plancka. U podstaw teorii atomu Bohra leżą tzw. postulaty Bohra głoszące, że:
1. Atom nie wypromieniowuje energii, jeżeli elektron porusza się po orbicie, na której jego kręt jest całkowitą wielokrotnością h / 2π (są to tzw. orbity dozwolone, stacjonarne);
2. Emisja promieniowania następuje wówczas, gdy elektron w atomie przeskakuje z dalszej na bliższą jądra dozwoloną orbitę;
3. Kwant emitowanego promieniowania v = (E2-E1) / h, gdzie E1 i E2 - energie elektronu odpowiednio na bliższej i dalszej orbicie.
n1 |
n2 |
Nazwa |
Granica serii |
Położenie |
1 |
|
seria Lymana |
91nm |
ultrafiolet |
2 |
|
seria Balmera |
365nm |
światło widzialne |
3 |
|
seria Paschena |
821nm |
podczerwień |
4 |
|
seria Bracketta |
1459nm |
|
5 |
|
seria Pfunda |
2280nm |
|
6 |
|
Seria Humpreysa |
3283nm |
|
III. Wyposażenie stanowiska
Lampy spektralne: hel i wodór, uchwyt do lamp spektralnych, zasilacz wysokiego napięcia 0 - 10 kV, statyw, siatka dyfrakcyjna, siatkowy mikrospektrometr światłowodowy, komputer.
IV. Wykonanie ćwiczenia
Ostrożnie umieścić lampę helową w uchwycie i podłączyć do zasilacza.
Włączyć zasilanie i zwiększać napięcie na lampie aż do uzyskania stabilnego świecenia.
Przeprowadzić obserwację widma emitowanego przez lampę obserwując lampę wyładowczą poprzez siatkę dyfrakcyjną.
Oświetlić otwór wejściowy spektrometru światłowodowego wprowadzając koniec światłowodu w boczny otwór osłony lampy wyładowczej.
Włączyć zasilanie spektrometru; na obudowie zapala się wówczas czerwona dioda sygnalizacyjna.
Uruchomić program obsługi spektrometru (program "SPM"). W „Ustawieniach” przyjąć uśrednianie 10, a czas ekspozycji co najmniej 100 milisekund.
Uruchomić "Pomiar". W czasie pomiaru mysz jest nieaktywna. Po zakończeniu pomiaru, korzystając z kursora, odczytać wartości wszystkich długości fali odpowiadające maksimom występującym w widmie emisyjnym lampy wyładowczej. Położenie kursora podawane jest w prawym górnym rogu ekranu monitora.
Widmo można zapisać na dysku twardym korzystając z instrukcji „Zapisz".
Zmniejszyć napięcie zasilacza do zera, a następnie wyłączyć zasilacz, po czym odłączyć od obudowy lampy końcówkę spektrometru światłowodowego.
Wymienić ostrożnie rurę wyładowczą na rurę wypełnioną wodorem, podłączyć do niej końcówkę światłowodową.
Powtórzyć czynności z punktów 5 - 7. Pomiar kilkakrotnie wykonać przy wydłużaniu czasu pomiaru tak, by w mierzonym zakresie widmowym dało się zarejestrować cztery linie widmowe wodoru. Zapisywać wyniki na dysku twardym pamiętając za każdym razem o zmianie nazwy.
Uwaga: szczególnie małe natężenie obserwuje się
dla linii o najkrótszych długościach fali.
Odczytać wartości długości fali i natężenia odpowiadające maksimom.
Po zakończeniu pomiarów zmniejszyć zasilanie lampy wyładowczej do zera, a następnie wyłączyć zasilanie lampy wyładowczej. Wyłączyć zasilanie spektrometru światłowodowego.
Gdzie:
λvac - długość fali w próżni światła emitowanego przez atom
RH - stała Rydberga dla wodoru
n1 i n2 - liczby całkowite ( n1 < n2 )
Z - liczba atomowa
Wyszukiwarka
Podobne podstrony:
rys, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
aaa, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
Nr ćwiczenia 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Pozio
Poziomy energetyczne atomu wodoru. Stała Rydberga, Elektrotechnika AGH, Semestr II letni 2012-2013,
poziomy energetyczne atomu wodoru, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
Wyznaczanie poziomów energetycznych atomu wodoru za pomocą spektroskopu pryzmatycznego
stany energetyczne atomu
Promieniowanie atomu wodoru
poziomy energetyczne konspekt, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laborato
poziomy energetyczne sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
Model budowy atomu wodoru postulaty Bohra
11 poziomy, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
F-2 Model atomu wodoru według Bohra
Rys 3-7 3-11 4-1 poziomopoRec, UEK, Rewizja Finansowa
Model Bohra budowy atomu wodoru
GUS gospodarka energetyczna 2010-11 - fragmenty, Energetyka Politechnika Krakowska Wydział Mechanicz
Środowisko programowe do obliczenia poziomów energetycznych studni kwantowych typu III V
Własności atomu wodoru według modelu Bohra
więcej podobnych podstron