Nr ćwiczenia |
Poziomy energetyczne atomu wodoru. Stała Rydberga
|
Ocena przygotowania teoretycznego. |
|||
11 |
|
|
|||
Nr zespołu |
Nazwisko i imię |
Ocena za sprawozdanie. |
|||
8 |
Jakub Gorycki |
|
|||
Data |
Wydział |
Rok |
Grupa |
|
UWAGI : |
013.03.2005 |
EAI i E |
I |
I |
|
|
Wprowadzenie teoretyczne:
Siatka dyfrakcyjna:
Zespół równoległych i równoodległych szczelin. przy padaniu na siatkę dyfr. Również powstają prążki interferencyjne .Wzajemna odległość kątowa tych prążków określona jest stosunkiem */d, gdzie d jest odległością miedzy środkami sąsiednich szczelin.
Zdolność rozdzielcza siatki: R=*/(**)
Obraz uzyskany w wyniku rozłożenia promieniowania opt. (światła) niemonochromatycznego na składowe o różnych długościach fal (różnych barwach), np. za pomocą pryzmatu, siatki dyfrakcyjnej nazywamy widmem optycznym. Może być emisyjne lub absorpcyjne. Widmo optyczne liniowe ma postać jasnych, barwnych prążków na ciemnym tle lub ciemnych prążków na tle widma ciągłego i charakteryzuje atomy pierwiastka chemicznego emitującego (lub pochłaniającego) to promieniowanie (jest związane ze zmianą poziomów energ. zewn. elektronów w atomie), w.o. pasmowe — jasnych lub ciemnych pasm powstałych ze zlania się b. gęsto rozmieszczonych linii widmowych i charakteryzuje cząst. związku chem. Widmo optyczne ciągłe emitują pobudzone do świecenia ciała stałe i gazy pod dużym ciśnieniem oraz swobodne atomy i cząstki., gdy zachodzą np. procesy fotojonizacji, rekombinacji lub fotodysocjacji
Serie widmowe wodoru:
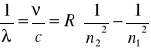
gdzie: ![]()
- długość fali
![]()
- częstotliwość fali
R - stała Rydberga = ![]()
![]()
, ![]()
- liczby kwantowe
W zależności od liczb kwantowych rozróżniamy następujące serie widmowe atomu wodoru:
Seria Lymana
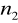
=1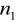
=2,3,4,5,6...Seria Balmera
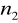
=2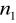
=3,4,5,6...Seria Paschena
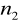
=3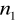
=4,5,6,7...Seria Bracketta
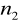
=4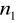
=5,6,7...Seria Pfunda
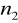
=5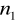
=6,7,8...Seria Humpreysa
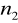
=6
=7,8,9…
Założenia Bohra:
elektrony krążą po orbitach stacjonarnych, na których nie emitują energii
wypromieniowanie następuje gdy atom przechodzi z jednego stanu do drugiego.
v =(En-Em)/h
Jako trzeci postulat podaje się, że moment pędu L jest skwantowany i równy nh/2π. W rzeczywistości, ten wynik jest u Bohra wnioskiem a nie założeniem. To co on założył, to zasada korespondencji:
"elektron emituje światło o częstości równej częstości swego ruchu orbitalnego".
Skąd (i z praw emisji) wyprowadza się warunek na moment pędu.
Ale tak naprawdę, trzeci postulat Bohra, to warunek fali stojącej: długość λ fali de Broglie'a elektronu na pierwszej orbicie jest taka (h/mv), że na obwodzie (2πr) mieści się tylko jej jedna, jedyna wielokrotność.
Energia jonizacji, energia odpowiadająca usunięciu najsłabiej związanego elektronu z atomu lub cząsteczki. Rozróżnia się pierwszą, drugą,. .. itd. energię jonizacji - odpowiadające usunięciu kolejnych elektronów.
Wyszukiwarka
Podobne podstrony:
rys, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
aaa, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Poziomy energetyczne atomu wodoru. Stała Rydberga, Elektrotechnika AGH, Semestr II letni 2012-2013,
Cwiczenie09 wyniki, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Nr 4 moje konspekt, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Cwiczenie 3 - sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratoriu
nr cw 3 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, la
Cwiczenie11 wyniki, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
cwiczenie 12, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, la
Cwiczenie 051, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, F
11 Poziomy energetyczne atomu wodoru Sta�a Rydberga
Nr ćwiczenia, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 10 Badanie
cw 11- opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
11 poziomy, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
poziomy energetyczne atomu wodoru, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
Opracowanie cw 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labork
11 opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
więcej podobnych podstron