Nr ćwiczenia
|
Temat ćwiczenia |
Ocena z teorii |
||
11 |
Poziomy energetyczne atomu wodoru. Stała Rydberga |
|
||
Nr zespołu |
Nazwisko i imię |
Ocena zaliczenia ćwiczenia |
||
8 |
Frenkel Szymon |
|
||
Data |
Wydział |
Rok |
Grupa |
Uwagi |
22 marca 2006 r. |
EAIiE |
I |
1 |
|
Cel ćwiczenia
Analiza spektralna światła emitowanego przez atomy wodoru, odtworzenie układu stanów energetycznych oraz wyznaczenie energii jonizacji atomu wodoru.
Teoria
Siatka dyfrakcyjna
Stała siatki d - odległość miedzy szczelinami
dsinq = ml , m = 0,1, 2,... - maksima interferencyjne (jasne prążki)
dyspersja kątowa (stosunek odległości kątowej linii do
różnicy długości fal)
Lśr/L=Nm - zdolność rozdzielcza (N - liczba szczelin, bierzemy pod
uwagę długości dwóch ledwo rozróżnialnych fal)
Model Bohra
Atom wodoru składa się z dodatnio naładowanego jądra oraz krążącego
wokół niego elektronu.
Elektrony mogą krążyć tylko po pewnych szczególnych orbitach, na
których moment pędu elektronu jest całkowita wielokrotnością określonej
stałej Plancka.
Jeśli elektron otrzyma z zewnątrz energie o odpowiedniej wartości, to
przeskoczy na dalsza od jądra orbitę.
Gdy elektron przeskakuje z dalszej orbity na bliższa, to emituje on kwant
światła o energii równej hn = DE .
Widma
Widmo emisyjne - powstałe w wyniku rozszczepienia światła
emitowanego bezpośrednio ze źródła
Widmo absorpcyjne - powstałe po rozszczepieniu światła, które przeszło
przez obiekt (materię dla niego przezroczystą) zdolny do selektywnego absorbowania części światła
Widmo odbiciowe - powstałe w wyniku rozszczepienia światła, które
wcześniej zostało selektywnie odbite
Widmo optyczne liniowe ma postać jasnych, barwnych prążków na
ciemnym tle lub ciemnych prążków na tle widma ciągłego.
Zakres widzialny 400-700 nm
Energia jonizacji - energia potrzebna do usunięcia najsłabiej związanego elektronu z
atomu (dla atomu wodoru wynosi ok. 13,6eV).
Wzór Rydberga: ![]()
(przejście z k-tej na m-tą orbitę,
R=1,097*107*1/m - stała Rydberga)
W zależności od liczb kwantowych rozróżniamy następujące serie widmowe atomu wodoru:
Seria Lymana
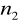
=1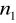
=2,3,4,5,6...Seria Balmera
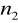
=2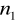
=3,4,5,6...Seria Paschena
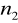
=3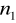
=4,5,6,7...Seria Bracketta
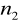
=4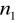
=5,6,7...Seria Pfunda
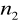
=5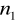
=6,7,8...Seria Humpreysa
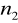
=6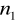
=7,8,9…
Wzór Balmera - określa długość fali poszczególnych linii widmowych atomów wodoru.
λ = λ0n2/(n2-4)
gdzie:
λ - długość fali danej linii widmowej,
λ0 = 364,57 nm,
n - szereg kolejnych liczb całkowitych 3, 4, 5, 6....
1
Wyszukiwarka
Podobne podstrony:
cw 11- opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
11 opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
rys, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
Nr ćwiczenia 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Pozio
poziomy energetyczne atomu wodoru, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
aaa, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
poziomy energetyczne konspekt, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laborato
poziomy energetyczne sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
Opracowanie cw 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labork
Poziomy energetyczne atomu wodoru. Stała Rydberga, Elektrotechnika AGH, Semestr II letni 2012-2013,
Sprawozdanie lab 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labo
konspekt11dobry, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Lepkość-sciaga, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
[4]tabelka, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
[8]konspekt new, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
FIZYK~47, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fizyka
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
więcej podobnych podstron