Tabele z wynikami pomiarów:
Metody obliczeń:
Wykres 1 przedstawia krzywą cechowania osi X programu obsługi spektrometru.
Zależność aproksymacji liniowej została obliczona metodą najmniejszych kwadratów.
λrzeczywiste = 0,994 λmierzone + 2,443
Skorygowane długości fali wodoru:
Wykres 2 przedstawia zależność: 1/dł. fali = f (1/n2)
Aproksymacja liniowa funkcji: y = -0.01114*x + 0.00275
Wyznaczając rzędna przecięcia z osią OY otrzymujemy głowicę pasma dla serii Balmera: 1/λ = 0,0025
Wzór
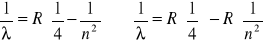
można przyrównać do powyższej aproksymacji. Otrzymamy w wyniku stałą Rydberga R=0,011 [nm-1] =
110000000 [m-1]Energia jonizacji atomu: Ejon = Rhc Ejon = 13,656 [eV]
Błąd wyznaczenia stałej Rydberga obliczam metodą pochodnej logarytmicznej:
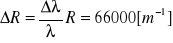
Ostatecznie:
R = 110'000'000 ± 66'000 [m-1]
Wnioski:
Hel |
||||
# |
λ [nm] |
Barwa |
||
387,701 |
fioletowy |
|||
447,833 |
niebieski |
|||
471,932 |
niebieski |
|||
501,952 |
zielony |
|||
589,143 |
żółty |
|||
670,321 |
czerwony |
|||
706,407 |
czerwony |
|||
730,122 |
czerwony |
|||
|
||||
|
|||||
# |
długość fali λ [nm] |
1/długość fali [nm-1] |
Natężenie względne |
1/n2 |
|
407,788 |
0,00245 |
210 |
0,0278 |
||
432,658 |
0,00231 |
520 |
0,0400 |
||
486,124 |
0,00206 |
754 |
0,0625 |
||
657,220 |
0,00152 |
1081 |
0,1111 |
||
Doświadczenie udowodniło charakter widma dla różnych źródeł światła. Jednak przede wszystkim dzięki zbadaniu charakterystyki widmowej wodoru, udało się obliczyć stałą Rydberga, której wynik jest bardzo zbliżony do tego podawanego w tablicach. Świadczy to o czystości gazu w lampie wyładowczej oraz o spektrometrze dobrej klasy. Badanie charakterystyki widmowej jest popularnym sposobem analizy składu chemicznego substancji (np. składu chemicznego gwiazd).
Wyszukiwarka
Podobne podstrony:
cw 11- opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
[4]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
[7]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
8 opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, l
[10]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
[8]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
[3]opracowaniemoje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
10 opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
[3]opracowaniemoje (2), Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, l
11 poziomy, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
[9]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Opracowanie11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, l
[5]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
8 opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, Sprawozdan
Opracowanie6, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, la
Opracowanie05, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, l
[6]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
[4]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Opracowanie cw 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labork
więcej podobnych podstron