Układ koloidalny, inaczej koloid to niejednorodna mieszanina dwóch substancji tworząca układ, w którym jedna z substancji jest rozproszona (zawieszona) w drugiej. Stopień rozdrobnienia substancji rozproszonej jest bardzo duży - tak duży, że fizycznie układ sprawia wrażenie substancji jednorodnej, jednak rozdrobnienie to jest mniejsze niż na poziomie pojedynczych cząsteczek. O układzie koloidalnym możemy mówić wtedy, gdy wielkość cząstek fazy rozproszonej sprawia, że ważne są zarówno oddziaływania pomiędzy fazą zdyspergowaną i dyspergującą, jak i oddziaływania wewnątrz obu faz.
Układ koloidalny (koloidy fazowe) jest układem składającym się z dwu faz:
faza ciągła - czyli substancja rozpraszająca, zwana też ośrodkiem dyspersyjnym albo dyspergującym
faza rozproszona - czyli substancja rozproszona (zdyspergowana), nierozpuszczalna w ośrodku dyspersyjnym (liofobowa, hydrofobowa)
Inny rodzaj koloidów to koloidy cząsteczkowe, gdzie fazą rozproszoną są makrocząsteczki, np. polimery (np. żelatyna, skrobia, białka) - nie występuje wówczas wyraźna granica fazowa, bo cząsteczki rozpuszczalnika mogą wnikać do wewnątrz makrocząsteczki - większość koloidów cząsteczkowych powstaje w sposób samorzutny w wyniku rozpuszczania w rozpuszczalniku (koloidy liofilowe, hydrofilowe). Niektóre ich właściwości są inne niż właściwości koloidów fazowych.
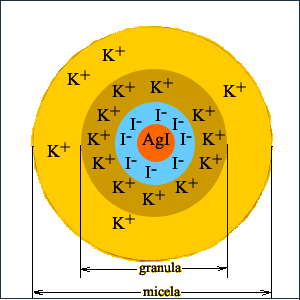
Micele-cząsteczki koloidowe. Micele to cząstki występujące w trwałych emulsjach. Tworzą je związki chemiczne o własnościach amfifilowych. Micele są kulistymi tworami zawierającymi od kilkudziesięciu do kilkuset cząsteczek.
Cząsteczki amfililowe posiadają zwykle wydłużony kształt, przy czym jeden ich koniec ma własności polarne a drugi apolarne. W rozpuszczalnikach polarnych, polarny koniec każdej cząsteczki "poszukuje" polarnego środowiska, na skutek czego samorzutnie ustawia się na zewnątrz miceli. Drugi, apolarny koniec "chowa" się we wnętrzu miceli na skutek czego ma kontakt z apolarnymi końcami innych cząsteczek i jest jednocześnie odseparowany od rozpuszczalnika. W przypadku gdy emulsja tworzy się w rozpuszczalniku apolarnym struktura miceli jest dokładnie odwrotna - polarne końce cząsteczek znajdują się w jej wnętrzu, zaś apolarne na zewnątrz.
Na granicy micel i rozpuszczalnika zachodzi zjawisko solwatacji, co powoduje, że micela składa się z kłębka cząsteczek substancji rozpuszczonej i cienkiej otoczki cząsteczek rozpuszczalnika na stałe związanej z micelą.
Środki powierzchniowo czynne - zwiększanie stężenia
Po wysyceniu granicy faz cząsteczki środków powierzchniowo czynych zaczynają organizować się w roztworze
Korzystne energetycznie jest dobre solwatowanie cząsteczek, tworzą się agregaty i micele,
Wzrasta stopień uporządkowania układu -zmieniają się właściwości fizykochemiczne
Krytyczne stężenie miceli (CMC)
Charakterystyczne stężenie środków powierzchniowo czynnych w w układzie
Środki powierchniowo czynne zaczynają organizować się w micele.
Wysycenie granicy faz
Cząsteczki środków powierzchniowo czynnych zaczynają organizować się wewnątrz układu
Skutki:
Minimalizacja niekorzystnych oddziaływań.
Korzystna konfiguracja energetyczna.
CMC - Critical Micelle Concentration - krytyczne stężenie miceli
stężenie środków powierzchniowo czynnych, w którym pojawiają się micele
Dramatyczna zmiana właściwości fizykochemicznych roztworu:
Napięcia powierzchniowego, przewodnictwa itp..
CMC jest wartością charakterystyczną dla danego środka powierzchniowo czynnego w danej temperaturze
Wyszukiwarka
Podobne podstrony:
SI wstep
Zajęcie1 Wstęp
Wstęp do psychopatologii zaburzenia osobowosci materiały
układ naczyniowy wstep
ZMPST Wstep
Dekalog 0 wstęp
1 WSTEP kineza i fizykot (2)
01 AiPP Wstep
wstęp neg
Wyklad I Problemy etyczne Wstep
ochrona srodowiska wstep
Tajemnica ludzkiej psychiki wstep do psychologii
PS 1 Psychologia społeczna wstep
więcej podobnych podstron