1. Wiedząc, że energia wewnętrzna U = H - nRT, gdzie n = (suma liczby moli produktów gazowych - suma liczby moli substratów gazowych) i na podstawie posiadanej wiedzy spośród poniższych zdań, wskaż te, które są prawdziwe dla reakcji opisanej równaniem: 2 S02(g) + 02(g) 2 S03(g) H < 0
I. Energia wewnętrzna substratów jest większa niż energia wewnętrzna produktów.
II. Podwyższenie temperatury reagentów powoduje przesunięcie stanu równowagi reakcji w prawo.
III. Wzrost ciśnienia w układzie powoduje przesunięcie stanu równowagi w prawo.
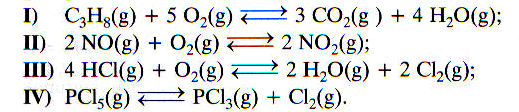
2. Wzrost ciśnienia przesunie stan równowagi w prawo w reakcji opisanej równaniem:
3. Jeśli obniżenie ciśnienia przesuwa stan równowagi reakcji w prawo, to można stwierdzić, że:
a) objętość reagentów podczas reakcji maleje; b) objętość reagentów podczas reakcji rośnie;
c) rośnie energia aktywacji; d) objętość reagentów podczas reakcji się nie zmienia.
4. W dwóch reaktorach: I i II przebiegają reakcje opisane równaniem:
I) CS2(g) + 3 02(g) <=> C02(g) + 2 S02(g) H0 = -1108 kJ; II) 3 H2(g) + N2(g) <=± 2 NH3(g) H° = -92 kJ.
Po ustaleniu się stanu równowagi reakcji I i II w obu reaktorach zwiększono ciśnienie w warunkach izotermicznych (T = 400 K). W nowym stanie równowagi można powiedzieć, że:
|
Liczba moli CS2
|
Liczba moli NH3
|
a
|
jest mniejsza
|
jest większa
|
b
|
nie zmieniła się
|
jest większa
|
c
|
jest większa
|
nie zmieniła się
|
d
|
jest większa
|
jest mniejsza
|
5. W układzie ustalił się stan równowagi reakcji przebiegającej zgodnie z równaniem:
A + 2 B AB2 H < 0.
Przesunięcie stanu równowagi w kierunku otrzymywania związku AB2 nastąpi po:
a) dodaniu do układu katalizatora; b) zwiększeniu stężenia reagentów A i B;
c) zmniejszeniu stężenia reagentów A i B d) podgrzaniu mieszaniny reakcyjnej;
e) ochłodzeniu mieszaniny reakcyjnej; f) odprowadzeniu z układu produktu AB2;
g) dodaniu do układu produktu AB2.
Które z powyższych stwierdzeń są prawdziwe?
6. W celu przesunięcia stanu równowagi reakcji opisanej poniżej równaniem w prawo należy:
4 NH3(g) + 3 02(g) 2 N2(g) + 6 H2O(c) H° = -1297 kJ
a) podwyższyć ciśnienie lub obniżyć temperaturę; b) obniżyć ciśnienie i obniżyć temperaturę;
c) zastosować odpowiedni katalizator; d) obniżyć ciśnienie i podwyższyć temperaturę.
7. w miejsca oznaczone (........... ) wpisz odpowiednie teksty. (zwiększone, zmniejszone)
W myśl ogólnych zasad reakcji przebiegających w fazie gazowej synteza amoniaku opisana równaniem
N2(g) + 3 H2(g) <=> 2 NH3(g) H° = -92 kJ
przebiega z największą wydajnością, jeżeli:
I) temperatura (..................................); II) ciśnienie (...........................); III) stężenie wodoru zostanie (........................).
8. W dwóch reaktorach przeprowadzona jest reakcja opisana równaniem: C3H8 (g) + 5O2(g) 3CO2 (g) + 4 H2O(g) H0 = - 1410,8kJ
Po ustaleniu się w obu reaktorach stanu równowagi, w pierwszym reaktorze (I) obniżono temperaturę, w drugim (II) zaś podwyższono ciśnienie. Zmiana warunków w reaktorach spowoduje przesuniecie równowagi w:
|
Reaktor l
|
Reaktor II
|
a
|
w lewo
|
w lewo
|
b
|
w lewo
|
w prawo
|
c
|
w prawo
|
w prawo
|
d
|
w prawo
|
w lewo
|
9. W celu przesunięcia stanu równowagi reakcji (opisanej poniżej równaniem) w kierunku wzrostu wydajności produktów:
2 C0(g) + 02(g) 2 C02(g) H = -568 kJ należy:
a) podwyższyć temperaturę i podwyższyć ciśnienie; b) obniżyć temperaturę i podwyższyć ciśnienie;
c) obniżyć ciśnienie i podwyższyć temperaturę; d) obniżyć ciśnienie i obniżyć temperaturę.
11. Równanie kinetyczne reakcji, w której bierze udział jeden substrat, a szybkość reakcji rośnie 27-krotnie przy 3-krotnym zwiększeniu stężenia substratu ma postać: a)v = k- 3[A]3; b) v = 27 • k[A]; c) v = k • [3A]3 ; d)v = k-[A]3
18. Ustal, w którą stronę przesunie się stan równowagi reakcji opisanej równaniem:
4 NH3(g) + 5 02(g) 4 N0(g) + 6 H2O(g) H < O
|
Podwyższenie temperatury
|
katalizatora
|
zwiększenie stężenia tlenu
|
a
|
w lewo
|
nie zmieni się
|
w lewo
|
b
|
w prawo
|
w prawo
|
w prawo
|
c
|
w prawo
|
w lewo
|
w prawo
|
d
|
w lewo
|
nie zmieni się
|
w prawo
|
35.W jaki sposób wpłynie podwyższenie temperatury układu na przebieg reakcji przedstawionej
poniższym równaniem? N2 + O2 ——> 2 NO H= 182 kJ.
|
Szybkość reakcji |
Stała szybkości reakcji |
Stała równowagi reakcji |
a |
wzrośnie |
wzrośnie |
wzrośnie |
b |
wzrośnie |
zmaleje |
wzrośnie |
c |
wzrośnie |
wzrośnie |
zmaleje |
d |
zmaleje |
zmaleje |
zmaleje |
41. Szybkość pewnej reakcji chemicznej wyrażono za pomocą równania: v = k • [A]x • [B]y• [C]z.
Na podstawie poniższych informacji doświadczalnych, określ wartość współczynników x, y, z występujących w równaniu kinetycznym reakcji.
I. Jeżeli stężenie związku A wzrasta 2-krotnie (przy niezmienionym stężeniu związków B i C), szybkość reakcji rośnie 8-krotnie.
II. Jeżeli stężenie związku B wzrasta 3-krotnie, to szybkość reakcji rośnie 27-krotnie (przy niezmienionych stężeniach A i C).
III. Jeżeli stężenie związku C wzrasta 4-krotnie, to szybkość reakcji też rośnie 4-krotnie (przy niezmienionych stężeniach A i B).
48. Wodór na skalę techniczną może być otrzymywany z gazu ziemnego w wyniku reakcji opisanej równaniem:
CH4(g) + H20(g) C0(g) + 3 H2(g) H = 206,1 kJ.
Podaj wyrażenie na stałą stężeniową (K) reakcji przebiegającej według powyższego równania,
Określ, jak zmieni się wartość stałej Kc, jeśli:
I) podwyższy się temperaturę; II) podwyższy się ciśnienie mieszaniny gazowej.
c. Określ, jaki wpływ na skład mieszaniny równowagowej będzie miał:
I) wzrost ciśnienia; II) wzrost temperatury; III) dodatek katalizatora.
49. Początkowe stężenie substancji wynosiło 3,9 mol/dm3, a po upływie 5 minut już tylko 2,1 mola/dm3. Zatem szybkość reakcji rozpadu tej substancji wynosi:
50 Ułożyć równania wyrażające prawo działania mas (wzór na stałą równowagi) dla następujących reakcji przebiegających w fazie gazowej:
2H2 + O2 = 2H2O 2CO + O2 = 2CO2
H2 + Cl2 = 2HCl 4NH3 + 5O2 = 4NO + 6H2O
51. Od czego zależy Stała szybkości reakcji k:
53. Tlenek siarki(VI) można otrzymać z tlenku siarki(IV), utleniając go w obecności tlenku azotu(II), co ilustrują poniższe równania reakcji:
I) NO + 1/2 O2 —> NO2;
II) NO2 + SO2 —> SO3 + NO.
Sumarycznie reakcję tę można zapisać następująco: 2 SO2 + O2 —> 2 S03
a. Do jakiego typu katalizy zaliczysz ten proces i dlaczego?
b. Zależność stałej równowagi reakcji od temperatury dla reakcji sumarycznej schematycznie podano na poniższym rysunku:
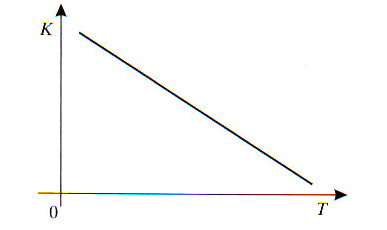
Do jakiego typu reakcji ze względu na efekt energetyczny zaliczysz tę reakcję do egzoenergetycznej, czy endoenergetycznej?
Określ, w jaki sposób wzrost temperatury wpłynie na wydajność procesu.
c) Podaj równanie kinetyczne reakcji sumarycznej i określ jak zmieni się szybkość tej reakcji jeśli dwukrotnie wzrośnie stężenie tlenku siarki (IV), natomiast stężenie tlenu i temperatura pozostaną bez zmian.
11.Narysuj wykres przebiegu reakcji bez katalizatora i z katalizatorem (na jednym wykresie), której energia substratów wynosi 150J, energia produktów wynosi 100 J, reakcja zachodzi dopiero przy energii 500J. Po zastosowaniu katalizatora wanadowego energia aktywacji reakcji spadła do 250J.
Oblicz efekt energetyczny reakcji ...............................................................................................
Określ typ reakcji chemicznej .....................................................................................................
Na szybkość reakcji wpływa:
A. stężenie i ciśnienie substratów
B. temperatura i katalizator
C. powierzchnia zetknięcia i mieszanie
D. rodzaj reakcji i substancje reagujące
E. wszystkie odpowiedzi są prawidłowe
Najmniejszą ilość energii potrzebną cząsteczkom do zapoczątkowania reakcji chemicznej nazywamy:
A. enargią wewnętrzną
B. kwantem energii
C. energią aktywacji
D. energią jądrową
E. energią jonizacji
19.
Która informacja najlepiej charakteryzuje katalizator:
A. substancja, która bierze udział w reakcjach i powoduje zmianę jej szybkości
B. substancja, która bierze udział w reakcji, wpływa na zmianę jej szykości, ale podczas rozpadu kompleksu aktywnego zostaje na końcu procesu zregenerowany
C. stanowi zawsze odrębną fazę niz substraty
D. jeden katalizator katalizuje tylko jeden rodzaj reakcji
E. nie wpływa na zmianę energii aktywacji
Dla poniższych reakcji stosunek k1/k2 nazywamy
COg + H2Og <=> CO2(g) + h2(g)
v1 = k1 * cCO * cH2O
v2 = k2 * cCO2 * cH2:
A. szybkością reakcji w stanie równowagi
B. stałą szybkości reakcji w stanie równowagi
C. stałą równowagi chemicznej K,sub>c dla T = const
D. zmianą stanu równowagi chemicznej
E. stanem równowagi dynamicznej
21.
Stała równowagi Kc zależy od:
A. rodzaju reakcji
B. rodzaju substratów
C. temperatury
D. rodzaju produktów
E. wszystkie odpowiedzi są prawidłowe
22.
Dla reakcji endo- i egzoenergetycznej wzrost temperatury powoduje:
A. reakcja endoenergetyczna - wzrost stałej równowagi Kc / reakcja egzoenergetyczna - wzrost stałej równowagi Kc
B. reakcja endoenergetyczna - wzrost stałej równowagi Kc / reakcja egzoenergetyczna - zmniejszenie stałej równowagi Kc
C. reakcja endoenergetyczna - stała równowagi Kc nie zmienia się / reakcja egzoenergetyczna - zmniejszenie stałej równowagi Kc
D. reakcja endoenergetyczna - zmniejszenie stałej równowagi Kc / reakcja egzoenergetyczna - zmniejszenie stałej równowagi Kc
E. reakcja endoenergetyczna - wzrost stałej równowagi Kc / reakcja egzoenergetyczna - stała równowagi Kc nie zmienia się
Kinetyka i statyka dla osób które nie zdają matury z chemii.
Co to jest szybkość reakcji chemicznej i w jakich jednostkach się ją wyraża. 2p
szybkość reakcji jest to ...............................................................................................................
jednostką szybkości reakcji jest ................................................................................................
Od czego zależy szybkość reakcji chemicznej. podaj cztery parametry. 2p
szybkość reakcji chemicznej zależy od:
.................................................................... .......................................................................
.................................................................... .......................................................................
Uzupełnij zdania: 2p
Szybkość reakcji jest wprost ................................... do iloczynu ..................................
substratów. Równanie określające zależność szybkości reakcji chemicznej od stężenia
reagentów nosi nazwę ...................................... .
Stała k w równaniu kinetycznym to ......................................... proporcjonalności , zależy on od
.......................... .
c
szybkość reakcji opisana jest wzorem: v = ± ------. 2p
t
Opisz użyte symbole v - ............................, c - ................................., t -..............................
kiedy wpisujemy +, a kiedy - do wzoru .........................................................................................................................................................
.....................................................................................................................................................
Napisz równanie kinetyczne reakcji dla równania: 2p
A + B = C + D .................................................................................................
2A + 3B = C ..................................................................................................
Napisz treść reguły przekory Le Chateliera i Brauna. 1p

7. Narysuj wykres przebiegu reakcji bez katalizatora i z katalizatorem, której energia substratów wynosi 150J, energia produktów wynosi 100 J, reakcja zachodzi dopiero przy energii 500J. Po zastosowaniu katalizatora wanadowego energia aktywacji reakcji spadła do 250J. 3p
Określ typ reakcji chemicznej .....................................................................................................
Oblicz energię aktywacji dla reakcji z katalizatorem ............................................
Spośród poniższych określeń podkreśl te, które dotyczą katalizatorów: 2p
obniża energię aktywacji, podwyższa energię aktywacji, zwiększ szybkość reakcji, zmniejsz
szybkość reakcji, reaguje z substratami reakcji, reaguje z produktami reakcji, nie reaguje z
reagentami reakcji, tworzy nietrwałe kompleksy z reagentami, nie zużywa się w czasie reakcji,
wyczerpuje się w czasie reakcji, jest zawsze ciałem stałym, może występować w różnych
stanach skupienia
9.
Stała równowagi reakcji K zależy od .........................................................................................,
a nie zależy od .................................................................................. 2p
10.
Oceń prawdziwość zdań. Przy prawdziwych wpisz T, przy fałszywych N 2p
katalizatory homogeniczne znajdują się w takim samym stanie skupienia co reagenty |
|
katalizatory heterogeniczne dodaje się dopiero wtedy, gdy reakcja jest blisko równowagi |
|
katalizatory homogeniczne zużywają się w czasie reakcji, a heterogeniczne nie, gdyż są ciałami stałymi |
|
enzymy są katalizatorami |
|
11.
Napisz wzór na stałą równowagi chemicznej dla reakcji: 4p
2NO + 2H2 = N2 + 2H2O ......................................................................
CH3COOH + CH3OH = CH3COOCH3 + H20 ...................................................................
2H2S = 2H2 + S2 ..................................................................................................
N2 + 3H2 = 2NH3 ...................................................................................................
12.
Przy wzroście temperatury o ........... stopni, szybkość reakcji .............. od 2 do ............ razy.
Jest to treść reguły ................................ 2p
13.
Co to jest energia aktywacji i jaki jest jej wpływ na szybkość reakcji 2p
Energia aktywacji jest to ............................................................................................................... .
Im wyższa wartość energii aktywacji, tym szybkość reakcji jest ..............................................
14.
Kiedy mówimy, że reakcja jest w stanie równowagi? 1p
15.
Spośród wymienionych poniżej podkreśl te czynniki, za pomocą których można wpływać na stan równowagi chemicznej, by go naruszyć. 1p
temperatura, ciśnienie, stężenie reagentów, środowisko reakcji, mieszanie, rozdrobnienie, katalizator
16. Oto niektóre reakcje zachodzące w gospodarstwie domowym. Uporządkuj je według rosnącej szybkości zachodzenia: 1p
a) kwaśnienie mleka b) gnicie owoców c) spalanie gazu w kuchence d) rdzewienie blach samochodowych.
..........................................................................................................................................................................................................................................................................................................................................................................................................................................................................
17. Aby określić zmiany szybkości reakcji magnezu z kwasem solnym, zanotowano objętość wydzielającego się wodoru po upływie określonego czasu: 5p
t(min) |
0 |
0,5 |
1 |
1,5 |
2 |
2,5 |
3 |
3,5 |
4 |
4,5 |
5 |
5,5 |
6 |
6,5 |
V(cm3) |
0 |
8 |
14 |
20 |
25 |
29 |
33 |
36 |
38 |
39 |
40 |
40 |
40 |
40 |
Narysuj wykres zależności objętości wydzielającego się wodoru od czasu:
Odpowiedz na pytania:
w której minucie reakcji szybkość jest największa ...................................................................
w której minucie reakcja dobiegła końca .................................................................................
jaka jest szybkość reakcji w czwartej minucie ......................... , a jaka w piątej ............... (szybkość podaj w cm3/min)
jaka jest średnia szybkość reakcji (vśr = cała objętość/sały czas) ...........................................
Wykres do zadania 55 i 56
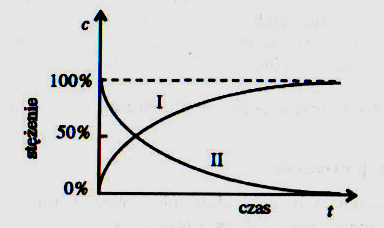
55. Krzywa I na poniższym wykresie przedstawia:
(A) zmianę stężenia reagentów w czasie reakcji
(B) wzrost stężenia substratów w czasie reakcji
(C) wzrost stężenia produktów w czasie przebiegu reakcji
(D) wzrost stężenia procentowego roztworu
(E) proporcjonalny wzrost stężenia substratów do czasu trwania reakcji
56. Krzywa II na wykresie z poprzedniego zadania przedstawia:
(A) zmianę stężenia reagentów w czasie reakcji
(B) spadek stężenia substratów w czasie reakcji
(C) spadek stężenia procentowego roztworu
(D) wzrost stężenia produktów w czasie reakcji
proporcjonalny spadek stężenia produktów do czasu trwania reakcji
57. Stałą szybkości reakcji k wyrażamy w
A) mol/dm3 B) s C) g/s D) mol/(dm3. s) E) mol/s
58
Ułożyć równania wyrażające prawo działania mas dla podanych reakcji.
a) C(s) + O2(g) = CO2(g)
b) 2SO2(g) + O2(g) = 2SO3(g)
c) A(aq) + 3B(s) = C(aq)
d) 2CH4(g) + O2(g) = 2CO(g) + 4H2(g)
59. Najmniejszą ilość energii potrzebną cząsteczką do zapoczątkowania reakcji chemicznej nazywamy:
60. Poniższe schematy przedstawiają przebieg reakcji ................ energię aktywacji zaznaczono symbolem .....................................
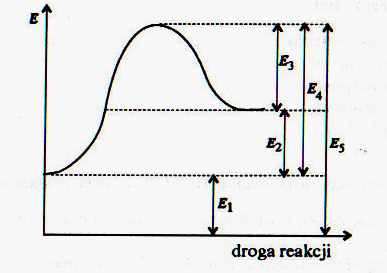
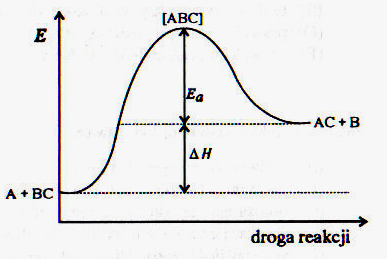
61. Który z wykresów przedstawia przebieg reakcji z katalizatorem, a który bez katalizatora. Wyjaśnij jak działają katalizatory chemiczne. Co to są enzymy.
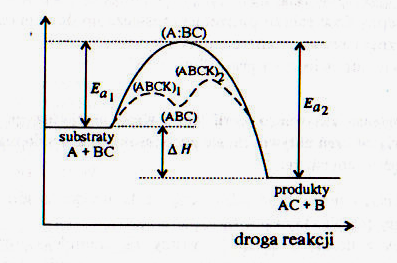
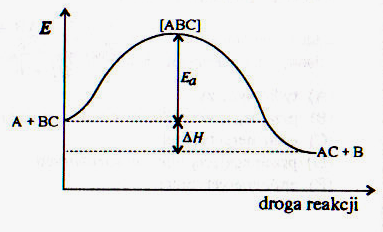
64. Poniższe równanie nazywamy: v = k . c
Współczynnik proporcjonalności k nazywamy:
65. Narysuj wykres zależności energii od czasu dla reakcji syntezy wody, wiedząc, że efekt cieplny tej reakcji wynosi H = - 242 kJ/mol
67. W których z podanych poniżej przykładów reakcja zachodzi z udziałem katalizatora?
I. Otrzymywanie tlenku siarki(VI) z tlenku siarki(IV).
II. Otrzymywanie etanalu z etynu.
III. Otrzymywanie amoniaku z N2 i H2.
IV. Otrzymywanie tlenku azotu(II) z amoniaku.
Podaj równania reakcji oraz stosowane w tych reakcjach katalizatory.
68.W celu ograniczenia negatywnego wpływu spalin na zanieczyszczenie powietrza w wielu krajach został wprowadzony obowiązek instalowania katalizatorów w pojazdach z stoikami spalinowymi. Głównym zadaniem tego typu katalizatorów jest:
a) redukcja związków ołowiu zawartych w gazach spalinowych do ołowiu metalicznego, który jest następnie osadzany na odpowiednich, wymiennych filtrach;
b) absorpcja tlenku azotu(IV) zawartego w gazach spalinowych na alkalicznym, wymiennym filtrze;
c) utlenianie tetraetyloołowiu zawartego w benzynie do tlenku ołowiu(IV);
d) utlenianie tlenku węgla(II) zawartego w spalinach samochodowych do tlenku węgla(IV) oraz redukcja tlenków azotu do azotu.
Wybierz poprawną odpowiedź.
69. Katalizatory samochodowe mają na celu obniżenie zawartości szkodliwych substancji w gazach spalinowych. W wyniku ich działania toksyczny tlenek węgla(II) jest przeprowadzany w tlenek wegla(IV), a tlenki azotu w azot. Tlenek azotu(IV) reaguje z tlenkiem wegla(II), dając azot i tlenek wegla(IV), lub z metanem, tworząc tlenek węgla(IV), azot i parę wodną.
Napisz równania tych katalizowanych reakcji,
Dlaczego w samochodach z katalizatorami nie należy używać benzyny zawierającej związki ołowiu?
70. W którą stronę przesunie się położenie stanu równowagi reakcji w każdym z poniższych układów przy wzroście ciśnienia wywieranego na układ? Oznacz plusem (+) poprawną odpowiedź.
Równanie reakcji
|
Przesunięcie równowagi
|
||
|
w lewo
|
w prawo
|
bez zmian
|
2 N0(g) + 02(g) 2 N02(g)
|
|
|
|
C2H6(g) C2H4(g) + H2(g)
|
|
|
|
N2(g) + 3 H2(g) 2 NH3(g)
|
|
|
|
2 Hl(g) H2(g) + I2(g)
|
|
|
|
2 N02(g) —— > N204(g)
|
|
|
|
2 C0(g) + 02(g) —— > 2 C02(g)
|
|
|
|
71 Wyjaśnij następujące pojęcia:
*autokataliza (podaj przykład); • aktywator; * inhibitor; • zatrucie katalizatora
Wyszukiwarka
Podobne podstrony:
Wnioski do spr z elektry 3, PW SiMR, Inżynierskie, Semestr V, syf, laborki, Lab. Ukł. Napędowych
Zadania do zestawu 4 - rozdzial 7, Psychometria, zadania i wzory
Zadanie do modułu 3, Studia, Semestry, semestr IV, Metody badań pedagogicznych, Zadania
Zadania do zestawu 2- rozdzial 6, Psychometria, zadania i wzory
GENETYKA 2, bio-zadania do matury
zadanie do oddania
Wykresy do spr 2 el i el
zadanie do tekstu grupy
opis zadania do tekst
F Zadania do kol 1 id 167111 Nieznany
Ekstrema warunkowe Zadanie do Rozwiazanie zadania domowego id
kible 2, Inżynieria środowiska, Inżynieria środowiska 1, Instalacje Sanitarne, Instalacje Sanitarne,
Instalacje-opis, Inżynieria środowiska, Inżynieria środowiska 1, Instalacje Sanitarne, Instalacje Sa
ODDYCHANIE, bio-zadania do matury
ZTFP wszystkie pyt do spr, fir II st II sem umcs, ztfp z fb
więcej podobnych podstron