GAZY SZLACHETNE
Blok p grupa 18-ta HELOWCE, elektrony walencyjne ns2np6. Zapełniony oktet. Pierwiastki bardzo mało reaktywne. Wysoki potencjał jonizacji, ujemne powinowactwo elektronowe, jedynie trwałe związki znane są dla ksenonu, pojedyncze nietrwałe dla kryptonu. Są to gazy szlachetne, tworzą cząsteczki jednoatomowe.
Helowiec |
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Elektrony walencyjne |
1s2 |
2s22p6 |
3s23p6 |
4s24p6 |
5s25p6 |
6s26p6 |
E.I. [kJ·mol-1] |
2372 |
2080 |
1520 |
1351 |
1170 |
1037 |
E.A. [kJ·mol-1] |
0 |
- 29 |
- 35 |
- 39 |
- 41 |
- 41 |
Promień atomowy [pm] |
128 |
186 |
174 |
— |
218 |
— |
Temp. wrzenia [K] |
4,2 |
27,1 |
87,3 |
120,3 |
166,1 |
208,2 |
Rozpow. pow. [vppm] |
5,2 |
18,2 |
93,4 |
1,1 |
0.087 |
|
Rozpow. kosmos [% at.] |
23 |
|
|
|
|
|
Hel (słoneczny) - 1868 Lockyer i Frankland, odkrycie helu na słońcu.
Argon (leniwy) - 1895 Ramsay, Krypton (ukryty), neon (nowy), ksenon (dziwny) - 1898 Ramsay i Travers. Hel - 1900 Ramsay i Travers. Izolacja helu z atmosferycznego neonu.
Radon (promienisty) - 1902 Rutheford i Soddy. Gaz promieniotwórczy o krótkim czasie półtrwania towarzyszący preparatom uranu.
Hel produkowany jest z gazu ziemnego (USA i Polska). Pozostałe helowce przez frakcyjną destylację skroplonego powietrza.
Zastosowanie: Hel - napełnianie balonów, uzyskiwanie najniższych możliwych temperatur, gaz nośny w chromatografii gazowej. Zastępuje azot w mieszance do oddychania dla nurków.
Neon - napełnianie rur wyładowczych neonowych.
Argon - szeroko stosowany w wielu procesach metalurgicznych, chemicznych i przy spawaniu metali. Napełnianie rur wyładowczych (neonów). Napełnianie żarówek.
Krypton - żarówki kryptonowe. Napełnianie rur wyładowczych (neonów).
Ksenon - lampy ksenonowe. Napełnianie rur wyładowczych (neonów).
Chemia gazów szlachetnych.
Hydrochinon
Klatraty w obecności gazów szlachetnych 1,4-C6H4(OH)2 krystalizuje tak, że trzy cząsteczki tworzą wnękę w której mieści się atom gazu (gość - guest). Między nim a cząsteczkami gospodarza (host) są tylko słabe oddziaływania dyspersyjne. G - Ar, Kr, Xe, CO, N2, O2, CH4.
[G{C6H4(OH)2}3], także z wodą krystalizuje [G8(H2O)46]
Związki ksenonu.
Bartlett: wiadomo, że PtF6 + O2 = [O2+][ PtF6-] I EI (O2) = 1177 kJ.mol-1
I EI (Xe) = 1170 kJ.mol-1 i stąd PtF6 + Xe = [Xe+][ PtF6-] uproszczone
a) Fluorki ksenonu.
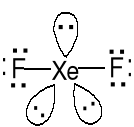
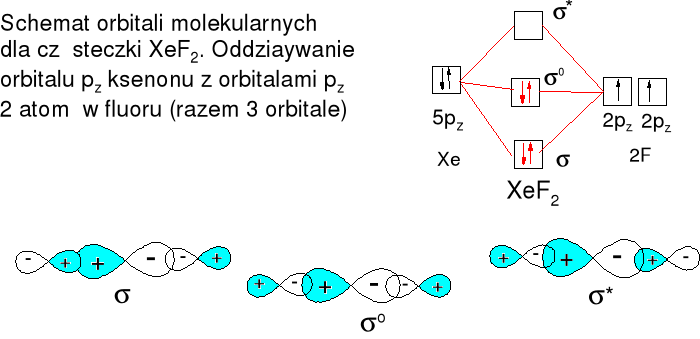
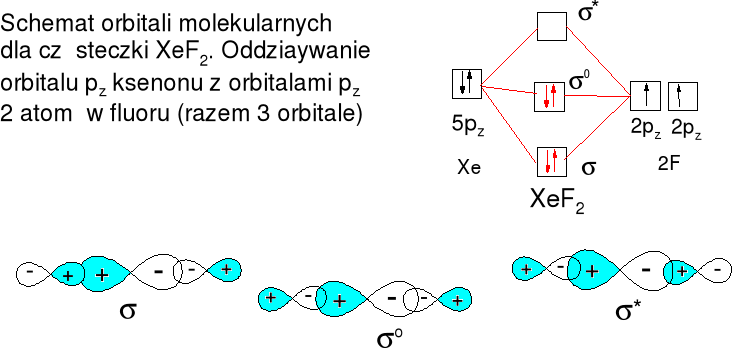
Xe + F2 = XeF2 (t > 250oC, nadmiar Xe)
Reakcja egzotermiczna: Xe(g) + F2(g) = XeF2(g) ΔH0 = -105 kJ·mol-1
Trwałe bezbarwne kryształy
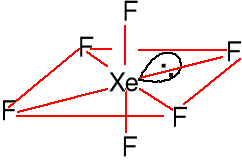
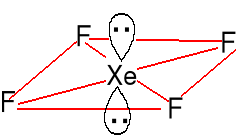
Struktura liniowa F-----Xe 200pm
AX2E3
XeF2(aq) + 2H+(aq) + 2e = Xe(g) + 2HF(aq) E0 = +2,32 V b. silny utleniacz.
2XeF2 + 4NaOH = 2Xe + 4NaF + O2 + 2H2O hydroliza szybka w środowisku zasadowym, wolna w kwaśnym i obojętnym.
Zapisz reakcję w formie jonowej XeF2 z wodą. Wskaż utleniacz i reduktor. Zapisz reakcję w środowisku obojętnym, także wydziela się tlen.
* XeF2(aq) + 2H+(aq) + 2e = Xe(g) + 2HF(aq) Zsumuj te dwa równania, H2O(l) → 2H+(aq) + ½O2(g) + 2e otrzymasz poszukiwane równanie.
------------------------------------------------------
XeF2(aq) + H2O(l) → 2HF(aq) + ½O2(g) + Xe(g)
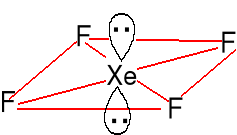
XeF2 + F2 = XeF4 Struktura płaska
(t ~ 400 oC, Xe/F2 = 1 : 5) kwadratowa
Trwałe bezb. kryształy
Znany jest także XeCl4.
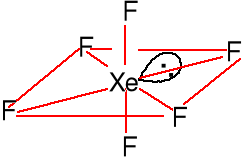
XeF4 + F2 = XeF6 Monomer - struktura
Trwałe bezb. kryształy oktaedryczna zdeform.
(t > 250 oC, p>50 atm)
AX6E wpływ steryczny wolnej pary mało widoczny.
c) Tlenowe związki ksenonu są znacznie mniej trwałe.
Hydroliza XeF6 XeF6 + 3H2O = XeO3 + 6HF
XeO3 - trwały w roztworach wodnych.
Wybuchowy w stanie suchym. Bezbarwne kryształy.
Związki kryptonu są znane, ale są znacznie mniej trwałe, dla radonu związki są z pewnością bardziej trwałe niż dla ksenonu ale radon jest
silnie promieniotwórczy, trudno dostępny i słabo zbadany.
4
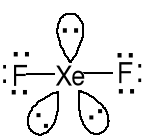
Wyszukiwarka
Podobne podstrony:
04-Wodór TECH, Materiały PG, Nieorgana
07-makroukłady TECH, Materiały PG, Nieorgana
13-fluorowceTECH, Materiały PG, Nieorgana
08-tlen, Materiały PG, Nieorgana
TCh1-stud1, Materiały PG, Nieorgana
11-dysocjacjaTECH, Materiały PG, Nieorgana
IR, Materiały PG, Nieorgana
05-OrbitalemolekTECH, Materiały PG, Nieorgana
Egzamin pisemny TChem 2010-tematy-1, Materiały PG, Nieorgana
Kresowa księga sprawiedliwych T 12 Studia i materiały Warszawa 2007 ISBN 978 83 60464 61 8
Materialy Budowlane-3R, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
FOLIE MIESZANKA BETON, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
Akustyka materiały pg gda
12 DEGRADACJA MATERIAŁÓW
12 Rozwiązania materiałowo konstrukcyjne i technologiczne budynków mieszkalnych, użyteczności publi
MATERIAŁY IZOLACYJNE NIEORGANICNE, MATERIAŁY IZOLACYJNE NIEORGANICNE
METODA 3 RÓWNAŃ- wzorki, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
więcej podobnych podstron