Sprawozdanie: Po sporządzeniu 10 buforów octanowych według instrukcji i po dodaniu roztworu kazeiny w kwasie octowym. Obliczyłem ilość moli i odpowiednie stężenia dla kwasu i soli. Wyniki obliczeń umieściłem w tabeli poniżej.
|
Lp. |
n CH3COOH |
n CH3COONa |
[CH3COOH] |
[CH3COO-] |
|
1 |
0,0020 |
0,0000 |
0,00050 |
0,00005 |
|
2 |
0,0018 |
0,0002 |
0,00045 |
0,00010 |
|
3 |
0,0016 |
0,0004 |
0,00040 |
0,00015 |
|
4 |
0,0014 |
0,0006 |
0,00035 |
0,00020 |
|
5 |
0,0012 |
0,0008 |
0,00030 |
0,00025 |
|
6 |
0,0010 |
0,0010 |
0,00025 |
0,00030 |
|
7 |
0,0008 |
0,0012 |
0,00020 |
0,00035 |
|
8 |
0,0006 |
0,0014 |
0,00015 |
0,00040 |
|
9 |
0,0004 |
0,0016 |
0,00010 |
0,00045 |
|
10 |
0,0002 |
0,0018 |
0,00005 |
0,00050 |
Następnie
po odwirowaniu próbek, pobrałem z każdej 2 ml roztworu i dodałem
do 4 ml odczynnika biuretowego (wcześniej przygotowanego w
probówkach). Po około 30 min. przeprowadziłem badania
kolorymetryczne dla danych prób Odczytaną absorbancje dla światła
o dłógości fali 530 nm. wraz z zawartością białka w roztworze
liczoną z krzywej wzorcowej o równaniu y=32,2x – 0,30 (gdzie y
oznacza zawartość białka w g/l, a x oznacza wartość odczytanej
absorbancji.) i pH roztworu buforowego (licznego ze wzoru
![]() gdzie
K = 1,753*10-5
to stała
dysocjacji kwasu octowego)Uzyskane wyniki przedstawiłem w tabeli.
gdzie
K = 1,753*10-5
to stała
dysocjacji kwasu octowego)Uzyskane wyniki przedstawiłem w tabeli.
|
Lp. |
Absorbrancja |
Zawartość białka [g/dm3] |
PH buforu |
|
1 |
0,10 |
2,92 |
3,76 |
|
2 |
0,06 |
1,632 |
4,11 |
|
3 |
0,00 |
0,0 |
4,33 |
|
4 |
0,00 |
0,0 |
4,52 |
|
5 |
0,00 |
0,0 |
4,68 |
|
6 |
0,00 |
0,0 |
4,84 |
|
7 |
0,00 |
0,0 |
5,00 |
|
8 |
0,02 |
0,344 |
5,19 |
|
9 |
0,14 |
4,208 |
5,41 |
|
10 |
0,16 |
4,852 |
5,76 |
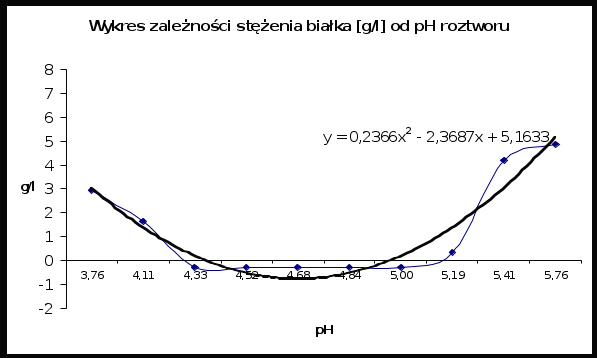
Wnioski:
Z wykresu punkt izoelektryczny dla kazeiny jest równy prawie 4,7 pH. Pomimo uzyskania dość płaskiego minimum dla punktów doświadczalnych wynik jest dość bliski wartości spodziewanej(znaleziona wartość pH=4,68). Wynika z tego ze kazeina zachowuje strukturę obojętną w dość kwaśnym środowisku.
Wyszukiwarka
Podobne podstrony:
204
884649 204
204 Ayers Rock Uluru
MERCEDES C 204 2007pl
204 208id 28757 Nieznany
204
cwiczenie 204
Rozdział 7 strony 191-204 bezpodstawne..., prawo cywilne, prawo cywilne część II, Zobowiązania
204 (Naprawiony)
biuletyn 204 nr6 httpwww arr gov pldata400biuletyn 204 nr6
204
884340 204
Śpiewnik 204
highwaycode pol c10 szczegulna ostroznosc (s 70 76, r 204 228)
Ir 1 (R 1) 203 204 Załącznik 7
571 204
204