Napięicie powierzchniowe
ciecze w odróżnieniu od gazów mają dobrze ukształtowane powierzchnie oddzielające je od otoczenia
Okazuje się, że siły wzajemnego odziaływania miedzy cząsteczkami na powierzchni cieczy są większe
od sił oddziaływania miedzy cząsteczkami wewnątrz fazy ciekłej.
Dla cząsteczek na powierzchni cieczy: siły przyciągania tych cząsteczek nie są zrównoważone od strony gazu
i mają tendencje do wciągania cząstek w głab cieczy. Na powierzchni cieczy jest zgromadzona pewna
energia E zwana energią powierzchniową cieczy. Energia ta jest proporcjonalna do
powierzchni cieczy A, czyli:
dE=d * dA lub E=d * A
d -współczynnik proporcjonalności zwany napięciem powierzchniowym
d [N/m] lub [J/m^2]
Napięcie powierzchniowe cieczy-definiuje się jako pracę potrzebną do zwiększenia powierzchni
cieczy o jednostkę np. 1 m^2 , 1 cm^2. Napięcie pow. jest własnością wąskiej perzestrzeni oddzielającą
jedną fazę od drugiej.
W skutek występowania napięcia powierzchniowego powierzchnia cieczy jest jakby pokryta elastyczną,
bardzo cienką błoną. Napięcie pow. cieczy zależy od rodzaju cieczy i temperatury sąsiadującej z nią fazy.
Nap. pow. roztworów zależy także od stężenia.
Ilościowa teoria wiążąca zmiany napięcia powierzchniowego z adsorpcją substancji rozpuszczonej na
powierzchni roztworu opracował Gibbs
a= -(c/R*T)*(sd/sc)A
p-stała gazowa
T-temp.absorpcji
d-napięcie powierzchniowe
c- stężenie
*Gdy substancja rozpuszczona wraz ze wzrostem stężenia obniża napięcie powierzchniowe (sd/sc)A wówczas
ma wartość ujemną i adsorpcja jest dodatnia.
*Gdy (sd/sc)A ma wartość dodatnią wówczas substancja rozpuszczona wraz ze wzrostem stężenia podwyższa
napięcie powierzchniowe i stężenie substancji rozpuszczonej jest na powierzchni mniejsze, niż w roztworze
czyli mamy adsorpcję ujemną
*Gdy (sd/sc)A = 0 stężenie substancji rozpuszczonej jest takie samo na powierzchni jak i w głębszych warstwach roztworu
Metody pmiaru napięcia powierzchniowego
1.) Metoda kapilarna.
w metodzie tej mierzy sie wysokość h, do której wznosi sie ciecz w rurce kapilarnej o pomieniu r. Siła napięcia
powierzchniowego P, skierowana do góry jest równoważona przez cieżar słupa cieczy G
P=d*2pr
G=m*g ; m=dc*V ; dc-gęstość cieczy V-objętosc słupa cieczy V=pr^2 * h
d*2pr =dc * pr^2 * h * g
d= dc*r*h*g/2
2.) Metoda kroplowa (stalagmometryczna).
Stalgmometr jest to rurka dwukrotnie zgięta, zaopatrzona w mały otwór. Ciecz wyplywająca z pionowej grubościennej
kapilary przez otworek u dołu zbiera sie w postaci kropli. Kropla narasta stopniowo i odrywa sie dopiero wtedy gdy jej
cieżar zrówna sie z siłą napiecia powierzchniowego.
mg=d*2pr
m=V*dc/n
V*dc*g/n=d*2pr
d=V*dc*g/2pr*n
m- masa kropli
g-przyspieszenie ziemnskie
r-promien koła wzdłuż którego obwodu odrywa się kropla
dc-gęstość cieczy
n-liczba kropli wyplywajacych w czasie opróznienia stalagnometru
V-objętośc cieczy
3.)Metoda pęcherzykowa.
Do naczynka pomiarowego nalewa sie pewną ilość wody i umieszcza się je w termostacie wodnym o stałej temperaturz.
Następnie do naczynka wkłada się kapilarę i łączy ją z lewym ramieniem manometru za pomocą węża gumowego. Do
prawego ramienia manometru wkrapla się ciecz manometryczną za pomocą wkraplacza. W miarę wkraplania cieczy
manometrycznej w kapilarze wzrasta ciśnienie powietrza. Gdy z kapilary zaczną uchodzić pęcherzyki powietrza wtedy
przerywa się dalsze wkraplanie cieczy i odczytuje się różnice poziomów h1. Następnie obniża sie wartośc ciśnienia w
kapilarze. W momęcie pojawienia sie pęcherzyków powietrza , korzystając ze wzoru:
p=(d1*h1 - dw*hz)*9.81
d1-gęstosć cieczy manometrycznej
hz-głębokość zanurzenia kapilary
dw-gęstość wody
Pomiedzy napięciem powierzchniowym cieczy d promień kapilary r oraz ciśnienie powietrza p w kapilarze zachodzi
zależność:
r=2d/p
znająć r i p możemy obliczyć napięcie powierzchniowe d
Zależność napięcia powierzchniowego od temperatury.
W miarę podwyższania temperatury napięcie powierzchniowe cieczy maleje i w pobliżu temperatury krytycznej osiąga
wartosc zero.
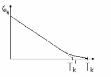
w temperaturze krytycznej linia ulega zakrzywieniu i po pewnym czasie osiąga wartość zero...
Zależność Eótrosa:
molowe napięcie powierzchniowe dM=d*V^(2/3)
k(T'kr-T)=d*V^(2/3)
V=M/d
V-objętość molowa
V^(2/3)-odpowiada powierzchni
Tkr-temperatura krytyczna
k- współczynnik, który dla większości cieczy wynosi 2,1*10^(-7) J/K
Zwilżalność vs. Niezwilżalność
*Warynek zwilrzalności-jeżeli mamy trzy fazy stykające się ze sobą ,to na granicy ich zetknięcia ustala sie
równowaga sił napięcia powierzchniowego. Taki układ stanowią: ciało stałe, ciecz i gaz. Krople cieczy
znajdujące się na powierzchni płaskiej ciała stałego tworzą z nią kąt j zwany kątem zwilżania. Tworzy sie on
pomiędzy napięciem powierzchniowym c.stałego i cieczy, a napięciem cieczy i gazu.
1.) Przypadek nie zwilżania ciała stałego przez ciecz:
 dSG
=dSC+dCG*cosj
dSG
=dSC+dCG*cosj
2.) Przypadek zwilżania ciała stałego przez ciecz:

ciecz zwilżająca odnosi się do konkretnego ciała stałego np. woda nie zwilża wosku
*jeżeli j > 90 oznacza to ze siły przyciągania atomów A przez atomy C nie są tak silne, jak siły przyciągania
pomiędzy atomami A i ciecz nie zwilża ciała stałego.
*jeżeli j <90 , w tym przypadku pomiedzy atomami A i C istnieją stosunkowo duże siły przyciągania i ciecz
zwilża ciało stałe.
*jeżeli j = 0 ciecz rozlewa się całkowicie po powierzchni ciała stałego (całkowite zwilżanie)
*jeżeli j =180 to brak jest jakich kolwiek sił przyciągania pomiędzy cieczą i ciałem stałym (całkowity brak zwilżania)
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna, napiecie powierzchniowe
Pomiar napięcia powierzchniowego cieczy metodą stalagmomet, Technologia chemiczna, Chemia fizyczna
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
napiecie powierzchniowe VIII, Chemia fizyczna
napiecie powierzchniowe, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
napięcie powierzchniowe, Studia, Chemia, fizyczna, ćwiczenia
Wyznaczanie napięcia powierzchniowego cieczy metodą stalagmometryczną, Technologia chemiczna, Chemia
Pomia napięcia powierzchniowego, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, spr
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
Pomiar napięcia powierzchniowego, Sprawolki
Napięcie powierzchniowe
napiecie powierzchniowe od temp
Napięcie powierzchniowe (4)
Napiecie powierzchniowe id 3136 Nieznany
Pomiar napięcia powierzchniowego metodami odrywania i Du Nouy’a
33 'napięcie powierzchniowe, Pliki Studia
,Laboratorium podstaw fizyki, Pomiar napięcia powierzchniowego metodą odrywania i metodą stalagmomet