Politechnika Gdańska Wydział Budownictwa Wodnego
i Inżynierii Środowiska
Studia Dzienne
Rok akademicki: 2003/2004
ALKACYMETRYCZNA
ANALIZA MIARECZKOWA
12.12.03 Leszek Miazga
Gr. 2
1. Wstęp teoretyczny
Analiza chemiczna, identyfikacja (chemiczna analiza jakościowa) i oznaczanie ilościowe (chemiczna analiza ilościowa) składu substancji. Ze względu na sposób
(i obiekt) pomiaru rozróżnia się metody klasyczne analizy chemicznej (gł. pomiar masy lub objętości) i chemiczną analizę instrumentalną (pomiar własności fizycznych lub fizykochemicznych badanej substancji).
Chemiczna analiza jakościowa, analiza, której celem jest stwierdzenie
(lub wykluczenie) obecności jakiegoś składnika w badanej próbce. Identyfikację składników próbki dokonuje się za pomocą odpowiednich odczynników analitycznych, powodujących charakterystyczną reakcję, której towarzyszy zmiana barwy roztworu, płomienia, specjalnie stopionej perły (barwne perły) albo wytrącenie osadu.
Metody klasyczne analizy chemicznej, metody analityczne ilościowe, wykorzystujące pomiar masy osadu otrzymanego w toku analizy (analiza wagowa, metody wagowe, czyli grawimetryczne) lub objętości roztworu mianowanego zużytego w reakcji z oznaczanym składnikiem (analiza miareczkowa, czyli objętościowa).
Chemiczna analiza instrumentalna, dział analizy chemicznej obejmujący metody pomiaru własności fizycznych lub fizykochemicznych badanej próbki, określające np.: własności elektryczne i elektrochemiczne, własności optyczne, własności rozdzielania międzyfazowego, promieniotwórczość i inne.
Metody te, zwane instrumentalnymi, odróżnia od metod klasycznych znacznie wyższa czułość i szybkość analizy, która może być łatwo zautomatyzowana. Metody instrumentalne często umożliwiają oznaczenie badanego składnika nawet wtedy, gdy towarzyszy mu skomplikowana matryca. Aparatura pomiarowa stosowana w chemicznej analizie instrumentalnej jest na ogół bardzo kosztowna.
Miareczkowanie, w najprostszym przypadku czynność w analizie miareczkowej (metody klasyczne analizy chemicznej) polegająca na dodawaniu z biurety roztworu mianowanego (titranta) do roztworu substancji oznaczanej aż do osiągnięcia punktu końcowego miareczkowania.
Zależnie od rodzaju titranta wyróżnia się poszczególne metody analizy miareczkowej, jak alkalimetria i acydymetria (razem określane jako alkacymetria), jodometria i jodymetria, cerometria, argentometria, chromianometria, manganometria i inne.
Miareczkowania stosuje się również w wielu technikach chemicznej analizy instrumentalnej
Punkt równoważnikowy miareczkowania, PR, punkt miareczkowania, w którym oznaczana substancja w roztworze przereagowała ilościowo stechiometrycznie z titrantem. Przybliżeniem PR jest punkt końcowy miareczkowania (PK), który jest wyznaczany wizualnie lub za pomocą metod instrumentalnych (np. potencjometrii).
Alkacymetria obejmuje ilościowe oznaczenie kwasów i zasad w roztworach.
W przypadku oznaczania kwasowości badany roztwór miareczkujemy roztworem zasady o ściśle określonym stężeniu. Podobnie roztwór zasady o nieznanym stężeniu miareczkujemy roztworem kwasu o znanym stężeniu. Podstawą reakcji alkacymetrycznych jest reakcja zobojętniania, która zachodzi pomiędzy kwasem
i zasadą (NaOH + HCL = NaCL +H2O).
Zasadowość, alkaliczność, cecha roztworów elektrolitów, w których stężenie jonów wodorowych H+ jest mniejsze od stężenia jonów wodorotlenkowych OH-. Zasadowość jest miarą zawartości jonów wodorotlenowych, wodorowęglanowych
i węglanowych i innych posiadających zdolność wiązania jonów wodorowych.
Zasadowość oznacza się przez miareczkowanie próbki badanego roztworu, roztworem mocnego kwasu, początkowo wobec fenoloftaleiny jako wskaźnika a następnie wobec oranżu metylowego. W zależności od pH wyróżniamy:
- Zasadowość mineralna (wobec fenoloftaleiny) występuje wówczas, gdy pH wody jest większe od 8,3. Jest spowodowana obecnością jonów wodorotlenowych
i węglanowych. Tę zasadowość oznacza się przez miareczkowanie próbki silnym kwasem wobec fenoloftaleiny do pH 8,3.
- Zasadowość ogólna jest wywołana przez związki, pod wpływem, których pH wody lub ścieków jest większe od 4,5. Zasadowość ogólna powodowana jest obecnością jonów wodorotlenowych, węglanowych i wodorowęglanowych. Oznaczana bywa poprzez miareczkowanie próbki silnym kwasem wobec oranżu metylowego do PH 4,5. Wody o wartości PH mniejszej od 4,5 nie posiadają zasadowości.
Kwasowość jest powodowana obecnością kwasów (organicznych
i nieorganicznych) a także soli ulegających hydrolizie. Jeśli pH badanej próbki jest mniejsze od 4,5 to jest w niej zarówno kwasowość mineralna (spowodowana występowaniem mocnych kwasów) jak i ogólna (wywołana obecnością kwasów
i hydrolizą soli słabych zasad). Natomiast dla pH w przedziale pH od 4,5-8,3 określamy w niej kwasowość ogólną.
- kwasowość ogólną - miareczkujemy kwasy zawarte w próbce mianowanym wodorotlenkiem sodu do pH 8,3 wobec fenoloftaleiny,
- kwasowość mineralna - miareczkujemy kwasy mineralne zawarte w próbce roztworem NaOH do pH 4,5 wobec oranżu metylowego.
2. Przebieg ćwiczenia
Zasadowość
W kolbie umieszczamy 100 cm3 badanej próbki, następnie dodajemy kilka
(ok. 3-4) kropel fenoloftaleiny i w przypadku różowego zabarwienia miareczkujemy próbkę 0,1 n roztworem kwasu solnego do zaniku zabarwienia. Użytą objętość kwasu zapisujemy jako Vm. Następnie do tej samej próbki dodajemy oranżu metylowego (ok. 5 kropel) do wystąpienia koloru żółtego. Ponownie miareczkujemy roztworem kwasu solnego 0,1 n do pierwszej zmiany barwy z żółtej na pomarańczową. Łączną objętość zużytego kwasu oznaczamy jako Vog. Obliczeń dokonujemy według wzorów:
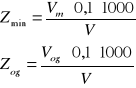
gdzie V to objętość badanej próbki w [cm3].
Kwasowość
W kolbie umieszczamy 100 cm3 badanego roztworu i dodajemy oranż metylowy i dodajemy 0,05n roztwór wodorotlenku sodu do pierwszej zmiany barwy
z różowego na słomkowo-żółty. Zużytą objętość zapisujemy jako Vmin. Następnie do tej samej próbki dodajemy fenoloftaleinę i miareczkujemy 0,05n roztworem NaOH do uzyskania różowej barwy utrzymującej się przez dłuższy czas. Łączną zużytą objętość zapisujemy jako Vorg. Kwasowość obliczamy według wzoru:
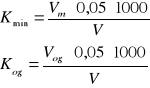
Podczas laboratorium dostałem próbkę nr 6. Próbka po dodaniu fenoloftaleiny nie zmieniła barwę na fioletową, co oznacza, że jej pH znajdowało się w przedziale
> 8,3 a więc dla badanej próbki należało wyznaczyć zasadowość mineralną.
Zakresy pH występowania kwasowości i zasadowości:
Zasadowość ogólna
Zasadowość mineralna
PH 4,5 8,3
Kwasowość mineralna
Kwasowość ogólna
3. Obliczenia
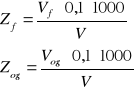
V = 100 cm3
Vf = 0,3 cm3
Vog = 8,5 cm3
Zf = 0,3 mval/dm3
Zog = 8,5 mval/dm3
4. Uwagi.
Zasadowość wody posiada istotne znaczenie przy ocenie wody do celów gospodarczych i technicznych. Natomiast znaczenie higieniczne jest drugorzędne.
Ścieki o wysokiej zasadowości mogą wywoływać zakłócenia w pracy oczyszczalni biologicznych oraz wpływać ujemnie na wody odbiornika. Oznaczenia zasadowości mineralnej i ogólnej metodą maireczkową nie należy wykonywać, gdy:
- barwa próbki jest większa niż 50 mg Pt/dm3,
- są w próbce składniki utleniające,
- jest dużo soli łatwo hydrolizujących żelaza i glinu,
- gdy od czasu pobrania próbki wody minęło ponad 4 godz.
Występowanie wodorowęglanów wyklucza obecność wodorotlenków, i na odwrót.
Wyszukiwarka
Podobne podstrony:
2 spr chemia, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
3 spr chemia, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
Lab 6, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
Lab 6 zasadowość, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
Lab 6 twardość, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
alkacymetria, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
Lab 8 weglanowa i niew, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
Lab 7 twardość, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
TWARDOSC, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
ZELAZO, Politechnika Gdańska Budownictwo, Semestr 3, Chemia, Sprawozdania
chemia-Kolokwium-Przykladowe-pytania-i-odpowiedzi, Politechnika Gdańska Budownictwo, Semestr 3, Chem
MDcw1, Politechnika Gdańska Budownictwo, Semestr 4, Metody doświadczalne w analizie konstrukcji, Spr
próba statycznego sciskania, Politechnika Gdańska Budownictwo, Semestr 4, Metody doświadczalne w ana
bb, Politechnika Gdańska Budownictwo, Semestr 4, Metody doświadczalne w analizie konstrukcji, Sprawo
WZOR STRONY TYTULOWEJ, Politechnika Gdańska Budownictwo, Semestr 4, Metody doświadczalne w analizie
CZO WKA BUDOWNICTWOOBL STA, Politechnika Gdańska Budownictwo, Semestr 4, Budownictwo Ogólne II, Pro
ELEKTROSTATYKA, Politechnika Gdańska, Budownictwo, Semestr I, Fizyka I, Ćwiczenia
PRZEDMIA, Politechnika Gdańska Budownictwo, Semestr 4, Budownictwo Ogólne II, Projekt, Jakieś inne p
więcej podobnych podstron