Zestaw II
1.Co to jest orbital? Podaj przykład.
Orbital jest to funkcja pozwalająca określić części przestrzeni wokół jądrowej największego prawdopodobieństwa napotkania elektronu (Ψ). W każdym orbitalu niezależnie od kształtu może znajdować się 1 max 2elektrony. Przykład:
2. Ile Jest możliwych orbitali dla głównej liczby kwantowej n=5?
Możliwe orbitale to s, p, d, f czyli cztery ???????????????
3. Jaka jest maksymalna ilość elektronów mogących zajmować orbitale: 5s, 3p, 4d?
Ponieważ: 5s-2e 3p-6e 4d-10e
4. Który z podanych oznaczeń orbitali są nieprawidłowe
a)2p, 3d b)2s, 3p c)2p, 3d d)3s, 4f
Wszystkie są błędne.
5. Dokonaj graficznego opisu poziomów orbitalnych (za pomocą klatek) dla pierwiastków. X, Z, Q o liczbach początkowych odpowiednio 20, 30, 35. Określ ile posiadają one elektronów walencyjnych. W jakich grupach układu okresowego się znajdują oraz do jakiego bloku pierwiastku należą?
![]()
2 elektrony walencyjne grupa 2 główna blok energetyczny s
Rysunek(klatki)
![]()
2 elektrony walencyjne grupa 2 poboczna blok p
rysunek 2(klatki)
![]()
7 elektronów walencyjnych grupa 7 główna blok p
Rysunek(klatki)
6. Z jakich cząsteczek elementarnych zbudowany jest nuklid (izotop) ![]()
? Wymień wszystkie
![]()
neutrony=A-Z=118
79-protonów
79-elektronów
7. W której grupie i w którym okresie znajduje się żelazo.
Fe 4 okres VIII grupa poboczna
8- Które pierwiastki wykazują większe podobieństwo chemiczne:
a)Krzem i German b)Krzem i Fosfor?
Si i Ge (krzem i german)
9- Wymień trzy kolejne pierwiastki o najmniejszej elektroujemności.
Frans, Bar, Stront.
10. Co jest dokładniejszym miernikiem dysocjacji: stopień dysocjacji czy stała K? Wyjaśnij dlaczego.
Lepszą miarą mocy słabych elektrolitów jest stała dysocjacji. Im jest ona większa tym elektrolit jest mocniejszy. Natomiast stopień dysocjacji wyraża jedynie procent liczby cząsteczek, które rozpady się na jony w stosunku do liczby cząsteczek wprowadzonych do roztworu.
11Napisz reakcję dysocjacji i wzór na stałą K dla związków:
![]()
![]()
![]()
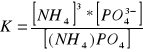
b)![]()
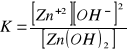
c)![]()
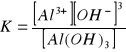
12.Jakie jest stężenie jonów hydroniowych w czystej wodzie w temp. 20°C.
![]()
13. Podaj reakcje, w której cząsteczka wody jest: a)kwasem b)zasadą
(wg. Broensteda).
Kwasy: to te które są dawcami protonów, zasady to te które są biorcami protonów.
![]()
woda jest zasadą ponieważ pobrała proton czyli wodór od kwasu octowego.
![]()
woda jest kwasem ponieważ oddała proton
![]()
14. Podaj po trzy przykłady soli, które po dodaniu do wody:
a) nie zmieniają jej pH b)powoduje wzrost pH
c) powoduje obniżenie ph. Podaj nazwę każdej soli.
a)![]()
- sól słabego kwasu i słabej zasady - mają odczyn obojętny azotanu(III)amonu,
b) ![]()
- sól słabego kwasu i mocnej zasady - odczyn zasadowy octanu sodu,
c)![]()
- sól słabej zasady i mocnego kwasu - odczyn kwaśny
15.Co to jest i o czym decyduje energia aktywacji? Czy można ją zamienić? Jeżeli tak to w jaki sposób?
Energia aktywacji- najmniejsza ilość energii jaka potrzebna jest cząsteczką do zapoczątkowania reakcji chemicznej oznaczamy ją jako EA . W momencie zapoczątkowania reakcji wydziela się duża ilość energii, powoduje ona uaktywnienie kolejnych cząsteczek dostarczając im właśnie energii. Zatem zainicjowana reakcja rozprzestrzenia się. Ponadto teoria kompleksu aktywnego, która ma bardziej ogólny charakter i zakłada iż podczas zderzenia cząsteczek substratów wytwarza się zespół atomów zwanych kompleksem aktywnych atomów.
16. Ile wiązań może utworzyć atom
a)azotu ![]()
odp)- trzy wiązaia
b)fluor :![]()
odp)-1 wiązanie
c)tlen :![]()
-odp)2 wiązania
18. Podaj mechanizm działania buforu mrówczanowego ( HOOOH, HCOONa)?
Ponieważ sole są mocnymi całkowicie zdysocjowanymi elektrolitami, zatem mrówczan sodu występuje w buforze mrówczanowym w postaci kationów ![]()
i anionów mrówczanowych ![]()
natomiast kwas HCOOH jako słaby kwas jest niezdysocjowany. Cząsteczki kwasu mrówczanego zgodnie z teorią Bronsteda np.:w wodzie protonami, natomiast jony ![]()
według tej teorii są zasadami gdyż pobierają proton. Zatem mieszanina złożona z kwasu mrówkowego oraz soli mrówczanu jest buforem ![]()
![]()
wywołują efekt wspólnego jonu →
HCOOH-protonodawca chroni układ przed zmianą pH poprzez dodawanie do zasady wodoru
.![]()
HCOO- protonobiorca chroni układ przed zmianą pH poprzez dodawanie do niego dużej ilości mocnego kwasu
.![]()
ponieważ w tej reakcji powstaje bardzo słaby kwas mrówkowy HCOOH to nie wpływa on na zmianę pH.
19.Wymień wszystkie znane ci rodzaje wiązań chemicznych i dla każdego rodzaju podaj 2 przykłady.
- kowalencyjne (atomowe) ![]()
|N≡N
kowalencyjne spolaryzowane ![]()
:
Wyszukiwarka
Podobne podstrony:
ZESTAW III IV1, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z che
ZESTAW III IV, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z chem
Test egzaminacyjny z chemii, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zali
S awek1, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z chemii, EGZ
ściąga do II ćwiczenia, Szkoła, penek, Przedmioty, Urządzenia nawigacyjne, Zaliczenie, egzamin, Ścią
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Roztwory, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
lozowicka egazm, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
Silownie i elektrownie1, Szkoła, penek, Przedmioty, Elektrotechnika, Zaliczenie
Hydroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
więcej podobnych podstron