NAZWISKO: NAJUCH
IMIE: TOMASZ
KIERUNEK:FIZYKA Z INFORMATYKĄ
ROK STUDIÓW: I
GRUPA LABORATORYJNA: X |
WYŻSZA SZKOŁA PEDAGOGICZNA W RZESZOWIE I PRACOWNIA FIZYCZNA |
||||
|
WYKONANO |
ODDANO
|
|||
|
DATA |
PODPIS |
DATA |
PODPIS |
|
Ćwiczenie Nr:
52
|
Temat:
Wyznaczanie stosunku CP/CV metodą Clementa - Desormesa. |
||||
1. Miarą ciepła właściwego gazu jest ilość ciepła potrzebna do ogrzania 1kg gazu o 1ºK. Ciepło to możemy wyznaczyć ogrzewając gaz pod stałym ciśnieniem (np. atmosferycznym)
i przepuszczając go przez mosiężny przewód. Wówczas gaz w kalorymetrze oziębia się pod stałym ciśnieniem, ciepło własne wyznaczone w tych warunkach oznaczamy przez Cp. Można również dokonać pomiaru ciepła właściwego utrzymując gaz w stałej objętości (oznaczamy wtedy przez Cv), jeżeli badany gaz zamknięty w szczelnym pojemniku i po ogrzaniu umieścimy w kalorymetrze. Jak wykażą obliczenia teoretyczne i pomiary dowiedziono, że Cp jest zawsze większe niż Cv. Przyczyną tego jest dodatkowa praca mechaniczna, którą musi wykonać ogrzewany rozprężając się pod wpływem stałego ciśnienia i części energii cieplnej dostarczonej masie gazu idzie na wykonanie tej pracy. Stosunek Cp/Cv, a więc stosunek ciepła właściwego przy stałym ciśnieniu do ciepła właściwego przy stałej objętości oznaczamy literą X.
X=Cp/CV
X=![]()
Stosunek Cp/Cv wykazują pewne prawidłowości. Dla gazów jednoatomowych jest on równy 1,67, dla dwuatomowych 1,4, a dla trzyatomowych 1,3.
2.Przemiana izotermiczna . Prawo Boyle'a-Mariotte'a.
Przemiana ta zachodzi w stałej temperaturze (T=const).
Ciśnienie określonej masy gazu w stałej temperaturze jest odwrotnie proporcjonalne do jego objętości.
![]()
lub
p1V1=p2V2
p
V
3.Przemiana izobaryczna. Prawo Gay-Lussaca.
Zachodzi pod stałym ciśnieniem (p = const).
Objętość określonej masy gazu pod stałym ciśnieniem jest wprost proporcjonalna do jego temperatury bezwzględnej.
![]()
V
p=const
T
4.Przemiana izochoryczna. Prawo Charlesa.
Zachodzi w stałej objętości (V=const).
Ciśnienie określonej masy gazu przy ogrzewaniu w stałej objętości jest wprost proporcjonalne do jego temperatury bezwzględnej.![]()
![]()
p
V=const
T
5.Przemiana adiabatyczna jest to przemiana , w której nie zachodzi wymiana ciepła
z otoczeniem. Zależność ta jest wyrażona wzorem Poissona
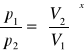
czyli
p1Vx=p2Vx
gdzie wykładnik potęgi 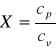
równy jest stosunkowi ciepła właściwego gazu pod stałym ciśnieniem do jego ciepła właściwego w stałej objętości
p
V
6. Przebieg doświadczenia
Zamykając kran wylotowy; przy pomocy pompki wtłoczyć do zbiornika powietrze utrzymując różnicę kilkudziesięciu milimetrów słupa cieczy
w manometrze.Przez odpowiedni obrót kurka zaworu odłączyć pompkę od zbiornika pozostawiając jednocześnie zamknięty kran wylotowy. Odczekać kilka minut na ustalenie się różnicy temperatur w zbiorniku i notować różnicę poziomów cieczy w manometrze.
Otworzyć kran wylotowy na przeciągu kilku sekund i po wyrównaniu się ciśnienia gazów w zbiorniku z ciśnieniem zewnętrznym zamknąć go ponownie.
Po pewnym czasie odczytać różnicę poziomów cieczy w manometrze.
Cykl pomiarów powtórzyć 10 - krotnie.
Na podstawie uzyskanych pomiarów wyznaczyć wartość X dla każdego cyklu pomiarów, a następnie obliczyć wartość średnią tej wielkości.
Wyznaczyć błąd maksymalny i określić przedział na wartości X.
Obliczenia:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Wyznaczam maksymalny błąd pierwszego cyklu pomiarów metodą pochodnej logarytmicznej:
błąd bezwzględny pomiaru h1 = δ( h1) = 1 [mm]
Δh = h1+h2 = δ( h1)+ δ( h2) = 1+1 = 2 [mm]
Wyznaczam błąd względny:
ε(X) = ![]()
Maksymalny błąd wyniku końcowego wynosi:
![]()
X = (1,16±0,09) [mm]
Określam przedział na wartość rzeczywistą X metodą Studenta-Fischera:
SX = 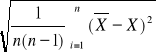
SX = 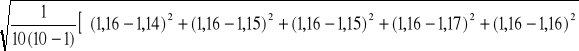
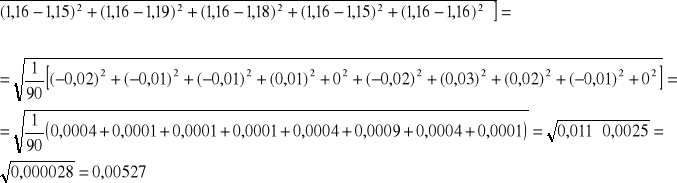
Przedział na wartość rzeczywistą X możemy zapisać
X = (1,16 ± tnαSX)
gdzie tnα = 2,3 , dla n = 10, α = 0,95
tnαSX = 2,3 0,00527 = 0,01
Ostatecznie wynik zapisujemy:
X = (1,16 ± 0,01)
Wnioski:
Uzyskana wartość X w doświadczeniu odbiega od prawidłowych wyników. Przyczyną może być zbyt krótki czas oczekiwania przed rozprężeniem, w wyniku czego temperatura sprężonego powietrza nie osiągnęła temperatury otoczenia.
1
Wyszukiwarka
Podobne podstrony:
aSDVF, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, MOJE CWICzeNIA
cwiczeni nr 24, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, MOJE C
pierwsza strona sprawozdania, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labol
obliczeniawwdd, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, MOJE C
Cwiczeni nr 5, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, MOJE CW
50B, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr50b
Ćwiczenie nr 35, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Siatka dyfrakcyjna, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćw
F-71, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr71
Kopia 46, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, 46
Lorentza-Lorenza2, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwi
Badanie widma par rtęci za pomocą spektroskopu, studia, Budownctwo, Semestr II, fizyka, Fizyka labor
92-fotokomórka, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Gotowe
Ćwiczenie nr 44, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Ćwiczenie nr 50a, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwic
Ćwiczenie nr 9, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicze
LAWA-2, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr72
więcej podobnych podstron