1. Część teoretyczna.
Przewodnictwo elektrolitów jest przewodnictwem jonowym. Zależy od: temperatury, stężenia, rodzaju elektrolitu (mocny czy słaby), oraz od rodzaju rozpuszczalnika. Wyróżnia się dwa rodzaje przewodnictwa:
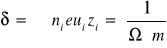
przewodnictwo właściwe, (odwrotność oporu właściwego), które jest sumą iloczynów liczby jonów, ładunku elementarnego, ruchliwości jonu i jego wartościowości, dla każdego rodzaju jonu:
przewodnictwo równoważnikowe, będące z definicji przewodnictwem mierzonym między elektrodami odległymi o 1m (lub 1 cm), lecz o takiej powierzchni S, by zawarła się między nimi objętość roztworu zawierająca gramorównoważnik związku. Różnice wartości przewodnictwa równoważnikowego dla różnych substancji są większe niż dla przewodnictwa właściwego.
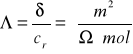
Przewodnictwo właściwe elektrolitu wyznacza się mierząc jego opór na mostku
Wheatstonea-Kohlrusha, przewodnictwo równoważnikowe wyznacza się poprzez powiązanie go z ruchliwościami jonów.
Pomiary przewodnictwa stosuje się do wyznaczania stałej dysocjacji słabego kwasu, wyznaczania iloczynu jonowego wody, wyznaczania iloczynu rozpuszczalności soli trudno rozpuszczalnej i miareczkowania konduktometrycznego.
Dla soli trudno rozpuszczalnej przyjmuje się, że:
![]()
Stężenie roztworu takiej soli będzie wyrażać się wzorem:
![]()
Zaś iloczyn rozpuszczalności dla soli o wzorze ogólnym AXBY:
![]()
2. Część eksperymentalna.
Badana ciecz |
przewodnictwo [S] |
|
|||
|
1 |
2 |
3 |
średnia |
|
Woda |
|
|
|
|
|
Roztwór soli |
|
|
|
|
|
Roztwór wzorcowy KCl |
|
|
|
|
|
3. Opracowanie wyników.
Obliczenie stałej naczynka:
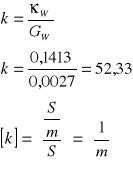
Obliczenie sumarycznego przewodnictwa właściwego wody i roztworu badanego.
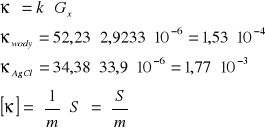
Obliczenie rozpuszczalności Agl:
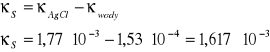
![]()
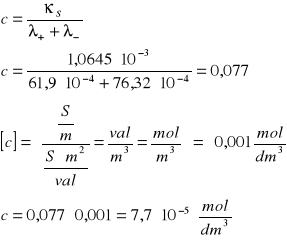
Obliczenie iloczynu rozpuszczalności AgI:
Dla soli typu AgI iloczyn rozpuszczalności określony jest kwadratem stężenia:
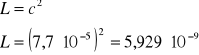
4. Wnioski.
Tak duży błąd spowodowany jest właściwością soli (jest to sól trudno rozpuszczalna), gdyż stosowana metoda daje dobre rezultaty głównie dla soli niezbyt trudno rozpuszczalnych. W przeciwnym przypadku błąd oznaczenia jest, jak widać powyżej bardzo duży i spowodowany małą różnicą przewodnictwa mierzonego soli i wody.
![]()
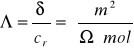
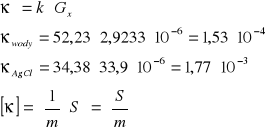
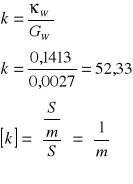
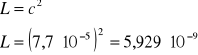
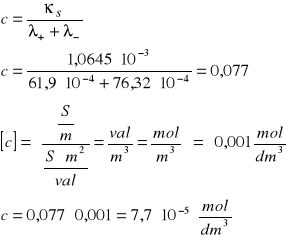
![]()
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 27, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
Sprawozdanie 7, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
Sprawozdanie 5, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, sprawka
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
więcej podobnych podstron