PK WIiTCh GR . 23 Zespół nr 8
|
ĆW . nr 5
Wyznaczanie stałej równowagi reakcji tworzenia kompleksów jodu z aromatami .
|
Data : 9.05.2000
|
|
1. Orzeł Krystyna 2. Trelińska Agnieszka 3. Kmieć Radosław 4. Prokurat Michał
|
|
Ocena :
|
Podpis :
|
|
|
|
|
1.Cząsteczki jodu tworzą połączenia z donorami elektronów, takimi jak związki aromatyczne. Są to kompleksy typu „charge transfer” ,czyli z przeniesieniem ładunku. Elektrony z pierścienia ulegają przesunięciu w kierunku bliższego atomu jodu. Stałe równowagi reakcji tworzenia tych kompleksów:
Ar +I2 = ArI2
K=![]()
są niewielkie. W widmie w nadfiolecie pojawiają się jednak bardzo silne pasma pochłaniania przy około 300 nm. W obszarze tym nie absorbuje ani czysty jod , ani też związki aromatyczne, dzięki czemu można zastosować spektrofotometr do badania stężenia powstających kompleksów.
Dla roztworu jodu i aromatu absorbancja równa jest sumie absorbancji jodu , aromatu i powstałego kompleksu . A zgodnie z prawem Lamberta - Beera absorbancja dla każdego z tych składników równa jest iloczynowi absorbancji molowej a , szerokości kuwety b , oraz stężenia składnika :
A= a b [Ar] + a b [I2] +a b [ArI2]
Stężenie wolnego jodu jest równe różnicy stężenia początkowego [I2] oraz stężenia kompleksu [ArI2] (podobnie jest ze stężeniem wolnego aromatu).
Jeżeli zastosujemy duży nadmiar aromatu w stosunku do jodu , to jego stężenie zmieni się bardzo niewiele w stosunku do początkowego i wówczas możemy napisać : [Ar] ![]()
[Ar]0![]()
Stała równowagi i wyrażenie na absorbancję przybierają postać :
K=![]()
a wyrażenie na absorbancję:
A= aAr b[Ar] + aI b([I2]0-[ArI2]) + aArI2 b[ArI2]
Jeśli z obu wyrażeń obliczymy [ArI2] i porównamy otrzymane wartości , to :
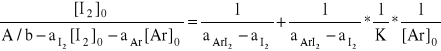
![]()
Równanie to ma postać równania linii prostej y = a x + b , gdzie x to odwrotność stężenia aromatu, a i b to stałe.
2. Cel ćwiczenia:
Wyznaczanie stałej równowagi reakcji tworzenia kompleksów jodu z aromatami.
3. Parametry i wyniki pomiarów.
Przygotowanie roztworów :
a) odczynniki - wykorzystujemy roztwory: 0,0004 molowy roztwór jodu w n-heptanie, 2 molowy roztwór o-ksylenu w n-heptanie.
b) roztwory jodu z aromatem przygotowujemy w kolbkach 10 próbek przez wymieszanie roztworu jodu i aromatu w odpowiednich stosunkach objętościowych. Objętość całkowita nie przekracza 3-3,5 cm3
Pomiar prowadzono:
dla kuwet napełnionych n-heptanem
dla kuwet napełnionych roztworem jodu
dla kuwet napełnionych roztworem aromatu w poszczególnych próbkach
Próbka |
Transmitancja T [%] |
Absorbancja A |
Aśr |
Roztwór jodu w n-heptanie 0,0004 m |
86,3 86,3 |
0,0639 0,0639 |
0,0639 |
Roztwór o-ksylenu w n-heptanie 2 m |
92,4 92,5 |
0,03431 0,03387 |
0,03409 |
Roztwór 1 (I2:Ar) 1:0,05 |
64,8 65,0 |
0,1884 0,1871 |
0,1877 |
Roztwór 2 1:0,30 |
36,3 35,6 |
0,4365 0,4486 |
0,4425 |
Roztwór 3 1:0,50 |
30,2 29,8 |
0,5200 0,5258 |
0,5229 |
Roztwór 4 1:1,75 |
28,8 28,0 |
0,5406 0,5528 |
0,5467 |
Roztwór 5 1:2,20 |
38,5 38,6 |
0,4145 0,4134 |
0,4139 |
Roztwór 6 1:4,1 |
46,9 47,1 |
0,3288 0,3270 |
0,3279 |
Roztwór 7 1:5,5 |
51,7 51,5 |
0,2865 0,2882 |
0,2873 |
Roztwór 8 1:8,5 |
59,5 59,0 |
0,2255 0,2291 |
0,2273 |
Roztwór 9 1:9 |
71,5 71,9 |
0,1457 0,1433 |
0,1445 |
Roztwór 10 1:10 |
41,9 41,7 |
0,3778 0,3799 |
0,3788 |
Obliczenia absorbancji molowej „a”
a =![]()
gdzie:
A - absorbancja średnia z tabeli
b - szerokość kuwety [ b = 0,998 cm ]
c - stężenie molowe
Absorbancja molowa |
a [dm3/mol cm] |
Roztwór jodu w n-heptanie |
160,07 |
Roztwór o-ksylenu w n-heptanie |
0,0170 |
f(A,[I2]0,[Ar]0 ) = ![]()
Wartość [I2]0 oraz [Ar]0 obliczamy ze znanych stężeń roztworów wyjściowych ich objętości użytych do przygotowania próbki.
Numer roztworu |
Objętość roztworu jodu [cm3] |
Objętość roztworu aromatu [cm3] |
Stężenie jodu w próbce [I2]o [mol/dm3]⋅10- 4
|
Stężenie aromatu w próbce [Ar]o [mol/dm3]. |
Aśr |
1/[Ar]o |
f(A,[I2]o,[Ar]o) |
1. |
2,66 |
0,14 |
3,8 |
0,1 |
0,2790 |
3,584 |
0,005806 |
2. |
2,15 |
0,65 |
3,07 |
0,46 |
0,4815 |
2,077 |
0,005808 |
3. |
1,86 |
0,94 |
2,65 |
0,67 |
0,5302 |
1,886 |
0,005811 |
4. |
1,02 |
1,78 |
4,08 |
1,27 |
0,4437 |
2,254 |
0,005812 |
5. |
0,87 |
1,93 |
3,48 |
1,37 |
0,3650 |
2,739 |
0,005813 |
6. |
0,54 |
2,26 |
0,77 |
1,61 |
0,2989 |
3,346 |
0,005813 |
7. |
0,43 |
2,37 |
0,61 |
1,69 |
0,1911 |
5,233 |
0,005812 |
8. |
0,29 |
2,51 |
0,41 |
1,79 |
0,1710 |
5,848 |
0,005813 |
9. |
0,28 |
2,52 |
0,40 |
1,80 |
0,1805 |
5,540 |
0,005816 |
10. |
0,25 |
2,55 |
0,36 |
1,82 |
0,1201 |
8,326 |
0,005812 |
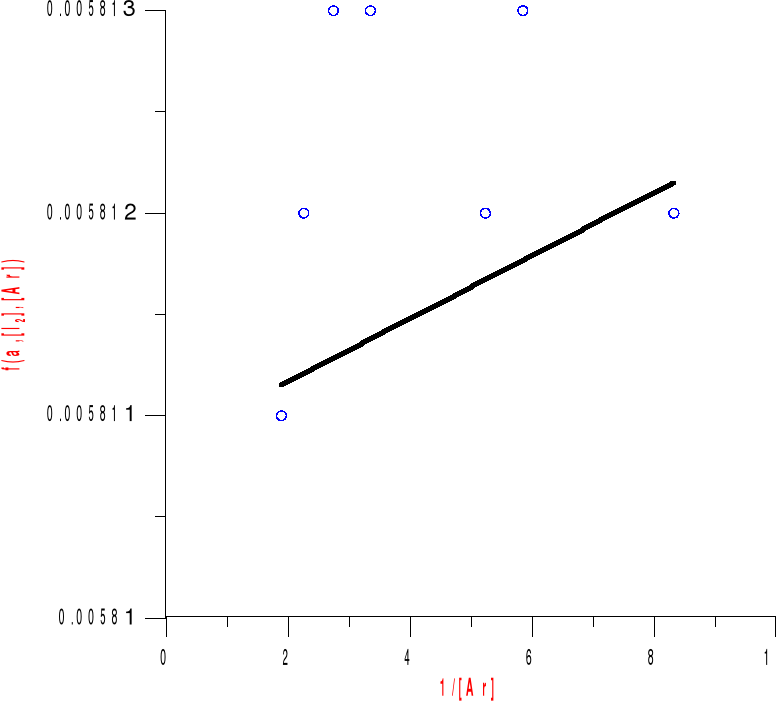
Obliczenie stałej równowagi K:
![]()
Z wykresu odczytujemy wartość funkcji w punkcie przecięcia z osią y równą :
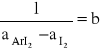
b = 0,0058076
Następnie obliczamy współczynnik nachylenia prostej tgα = a
a = 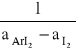
![]()
a = 0.7812856
Z tych dwóch wartości obliczamy stałą równowagi K .
K = ![]()
K = 0,0074
4. Wnioski:
Błąd pomiaru i niedokładna wartość stałej równowagi tworzenia kompleksu jodu z aromatami
mogą wynikać z :
Użycia lampy wolframowej (zamiast deuterowej ).
Nieprawidłowego odczytania wyniku pomiaru na skali miernika.
Niedokładności sporządzenia badanych roztworów.
Niedokładnie wyczyszczone i wysuszone kuwety pomiarowe.
5.Uzyskana w doświadczeniu wartość stałej K = 0.0074 wskazuje iż reakcja jodu z aromatami jest przesunięta w lewą stronę i że w badanych roztworach jod występował głównie w postaci nieskompleksowanej.
4
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron