Jacek Olender I rok KiR
ĆWICZENIE I - SPRAWOZDANIE
Część praktyczna
Podpunkt A
Treść: Otrzymać 110g roztworu NaOH, o stężeniu Cp=10%.
Obliczenia
Dane: Masa roztworu – 110g
Stężenie roztworu – 10%
Szukane: Masa substancji rozpuszczanej (NaOH) – x
Masa rozpuszczalnika (H2O) – x
Z wzoru wiadomo, że:

Po przekształceniu:
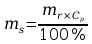

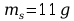
Mając masę roztworu – 110g oraz masę substancji – 11g, obliczono masę potrzebnego rozpuszczalnika ze wzoru:
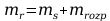
Po przekształceniu otrzymano wzór:
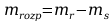

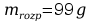
Mając do dyspozycji:
- Cylinder miarowy o poj. 100 cm3 i dokładności do 1 cm3
- Zlewkę o poj. 250 cm3
- Szkiełko zegarkowe
- Wodę destylowaną
- NaOH
Wykonano następujące czynności:
Zważono na wadze technicznej szkiełko zegarkowe
Na szkiełku zegarkowym odważono 11g NaOH
W cylindrze miarowym odmierzono 99 cm3 H2O
Przesypano do zlewki odważoną ilość NaOH i zalano odmierzoną ilością wody, przemieszano bagietką
Obserwacje
Podczas zachodzenia reakcji wydziela się ciepło.
Wnioski
Reakcja jest egzotermiczna.
Podpunkt C
Treść: Z roztworu NaOH o stężeniu procentowym 10% otrzymać 100 cm3 roztworu NaOH o stężeniu molowym równym 0,1mola/dm3.
Obliczenia
Dane: Gęstość roztworu pierwotnego – 1,010 g/ cm3
Masa molowa NaOH – 40 g/mol
Szukane: Objętość 10% roztworu NaOH potrzebna do przygotowania nowego roztworu.
Z proporcji wiemy, że skoro
 cm3, to
cm3, to
waga 1 cm3 = 1,010g, czyli
waga 1 dm3 = 1010g
Stężenie procentowe roztworu początkowego wynosi 10%. Oznacza to, że na każde 100g roztworu przypada 10g substancji rozpuszczonej. Z proporcji można więc obliczyć, iż na każdy 1dm3 przypada 101g NaOH:
10g substancji – 100g roztworu
X g – 1010g (masa 1dm3 roztworu)
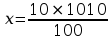
x = 101g NaOH na 1dm3 10% roztworu
Mając powyższe dane można obliczyć stężenie molowe 10% roztworu:
1 mol – 40g/mol
X mol – 101g
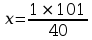
Cm = 2,525 mol/dm3
Korzystając z zasady, iż liczba moli w początkowym i końcowym roztworze jest równa (n0 = nt) można obliczyć ilość 10% roztworu NaOH potrzebnego do przygotowania 100 cm3 roztworu 0,1m.
Pamiętając, że
 ,
czyli
,
czyli
 oraz n0 = nt tworzy się wzór:
oraz n0 = nt tworzy się wzór:
n0 = nt, czyli:
Cm0 V0=Cmk
V0=Cmk Vk
Vk
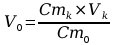
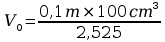
Dokonując przybliżenia:

V0=4cm3
Mając do dyspozycji przyrządy:
- Kolbę miarową o pojemności 100 cm3
- Pipetę wielomiarową o poj. 10 cm3 i dokładności do 1/10 cm3
Oraz odczynniki:
- Roztwór NaOH o stężeniu procentowym Cp=10%
- Wodę destylowaną
Wykonano następujące czynności:
Odmierzono do kolby miarowej pipetą 4 cm3 roztworu NaOH
Dopełniono wodą destylowaną do objętości 100 cm3
Wymieszano
Obserwacje: Nic nie zaobserwowano.
Wnioski: Prawdopodobnie podczas dalszego rozcieńczania zachodzi reakcja, która jest egzotermiczna, jednak przy tak niskich stężeniach nie da się tego zaobserwować bez odpowiednich przyrządów.
Wyszukiwarka
Podobne podstrony:
Lab 6 PMI Hartownosc Sprawozdan Nieznany
Mikrokontrolery Grodzki Sprawoz Nieznany
ProjektUnifikacja sprawozdanie Nieznany
Projekt zaliczeniowy Sprawozdan Nieznany
problematyka sprawozdawczosci M Nieznany
ProbabilistykaEND SprawozdanieA Nieznany
Sprawozdania Sprawozdanie2teori Nieznany
konserwanty wzor sprawozdania v Nieznany
Elektroenergetyka sprawozdanie Nieznany
2012 03 KPP Mikolow sprawozdani Nieznany (2)
Sprawozdania Sprawozdanie5teori Nieznany
Sprawozdania Sprawozdanie3prakt Nieznany
PFM 3 Instrukcje pisania sprawo Nieznany
Mikrokontrolery Grodzki Sprawoz Nieznany (2)
ETD3070L01 Przykladowe sprawozd Nieznany
destylacja z para wodna sprawoz Nieznany
Sprawozdania Sprawozdanie3teori Nieznany
Sprawozdania Sprawozdanie4teori Nieznany
Sprawozdania Sprawozdanie6teori Nieznany