Jacek Olender I rok KiR
ĆWICZENIE II - SPRAWOZDANIE
Część teoretyczna
Analiza objętościowa (miareczkowa) – polega na ilościowym oznaczaniu substancji na podstawie dokładnego pomiaru objętości roztworu dodawanego odczynnika miareczkującego (titranta), o ściśle określonym stężeniu (mianie), odmierzanego za pomocą biurety i reagującego z oznaczanym jonem.
Alkacymetria – obejmuje grupę metod analizy objętościowej opartych na reakcji zobojętniania, polegającej na przeniesieniu protonu od kwasu do zasady z utworzeniem słabo dysocjujących cząsteczek wody :
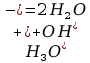
Wykorzystuje się reakcje zobojętniania mocnych kwasów mocnymi zasadami i odwrotnie, słabych kwasów, również kwasów wieloprotonowych, mocnymi zasadami oraz słabych zasad mocnymi kwasami.
Alkacymetria obejmuje dwa działy:
- Alkalimetrię – oznaczanie substancji przez miareczkowanie mianowanym roztworem zasady
- Acydymetrię – oznaczanie substancji przez miareczkowanie mianowanym roztworem kwasu
Punkt równoważnikowy (w skrócie PR) – punkt miareczkowania, w którym oznaczany składnik przereagował ilościowo i stechiometrycznie z titrantem.
Punkt końcowy – zasadniczy koniec miareczkowania. Określa się go na podstawie widocznych zmian zachodzących w roztworze miareczkowanym (np. zmiana barwy roztworu). Powinien się znajdować jak najbliżej punktu równoważnikowego.
Błąd systematyczny miareczkowania – różnica pomiędzy punktem równoważnikowym, a punktem końcowym miareczkowania.
Skok miareczkowania – gwałtowna zmiana wartości pH w pobliżu punktu równoważnikowego.
Wskaźniki pH (indykatory) służą do wyznaczania punktu końcowego miareczkowania alkacymetrycznego i określania pH roztworu. Są to związki, najczęściej słabe kwasy lub zasady organiczne, zmieniające barwę w określonym zakresie pH roztworu. W układach wodnych tworzą one układy sprzężone kwas-zasada. Jeżeli tylko jedna forma w układzie jest zabarwiona, co wynika z obecności grupy chromoforowej, wówczas mówi się wskaźnikach jednobarwnych (np. fenoloftaleina). Jeżeli dwie formy układu mają różne zabarwienia, wtedy są to wskaźniki dwubarwne (np. oranż metylowy).
Całkowita zmiana barwy wskaźnika występuje w zakresie dwóch jednostek pH. Zakres pH, w którym występuje przejściowe zabarwienie wskaźnika nazywa się zakresem zmiany barwy wskaźnika. Zakres ten zależy od całkowitego stężenia wskaźnika.
Wyszukiwarka
Podobne podstrony:
Lab 6 PMI Hartownosc Sprawozdan Nieznany
Mikrokontrolery Grodzki Sprawoz Nieznany
ProjektUnifikacja sprawozdanie Nieznany
Projekt zaliczeniowy Sprawozdan Nieznany
problematyka sprawozdawczosci M Nieznany
ProbabilistykaEND SprawozdanieA Nieznany
Sprawozdania Sprawozdanie1prakt Nieznany
konserwanty wzor sprawozdania v Nieznany
Elektroenergetyka sprawozdanie Nieznany
2012 03 KPP Mikolow sprawozdani Nieznany (2)
Sprawozdania Sprawozdanie5teori Nieznany
Sprawozdania Sprawozdanie3prakt Nieznany
PFM 3 Instrukcje pisania sprawo Nieznany
Mikrokontrolery Grodzki Sprawoz Nieznany (2)
ETD3070L01 Przykladowe sprawozd Nieznany
destylacja z para wodna sprawoz Nieznany
Sprawozdania Sprawozdanie3teori Nieznany
Sprawozdania Sprawozdanie4teori Nieznany
Sprawozdania Sprawozdanie6teori Nieznany