"O ~fOl+"Yłz.~ ""l'yml' Olny j·on.,,'U1 •.•. 1·
.b:i :t1oJ""'~.A~ "Y"I..I---· a -.!...Iu,.yi;,J~
Statykę wymiany jonowej można opisy-wać jako heterofazową reakcję chemiczną podwójnej wymiany, Donnanmvską równowagę membranową lub jako proces osmotyczny.
Wymiana jonowa jako heterofazowa reakcja chemiczna podwójnej wymiany:
n
m
+ m-
Hll
== -- A
m +
nlBll
.... __ ' nA .. _ ..
~ r --~~ J -- - J ~-- r
Jest charakteryzowana za pomocą termodynamicznej stałej równowagi reakcji KOA/B :
![]()
[
"}n
• fR
1m
J} t..I..J Jr
[
A
ln.rB]n:
Jr l }
![]()
1 •
gazIe:
r
l
[Rl - ~lctvumoS'I';
;0'00'
,\I UJ
ro'7tUJOr7P
{r\ ;
;no;";e
(;\
L .••.. J, ~J L&- .•.•••.•• J .•..•..•..•. ......, -..ii.J .•..•.•..•..•..•...•. ~ .••.....••. rT ••..•••.•• It...-_\.ilJ..LJ""L.L..L_..L V/,
fi, n - "Vfu1:ościOvvości jonÓ"\l.
"1 ~fOlłOl ,,";iU1nO' o i, .• " ""ion' 'ono'""'e· " "'nółC~'lnnl·k »odzioł"
Jd ."-"!lU"" "U'n u.Vug" nY~"" y J Hun J, .V"J!U- JL;:f!IJJA. pO' ,," J.
Dla roztworów dostatecznie rozcieńczonych można korzystać ze stężeniowej stalei równowagi KA/B, wtedy a.iztywności zastępujemy stężeniami:
fi m
CAj"cBr
C
n
fi Ar'
CB
'
]
D
lcrps'lent"
fiz"kn"hem;C7nvrh ,x1l"s'c;u1ns'Cl' ukladll
l'stntnvm
;P'lt ,xrvzn"r7pnl' p
,xr'lllAl,.7ynn;kAu1
_ .•• ~- _ ..••.•• .ł.ło.4» ,,-_v 'L - .••..•. _~ ..•. __ -- •••....••.•• ~J-_ .•...•.• ,. ..•. - ..•..•...•. - _ ......,- - ---, . -..., J ..•...•...•. J •••.•.•..•. Y"J ..., _..;~ lf'tv V-L_i/....O ..1. ..•...•.••.•• .,-11
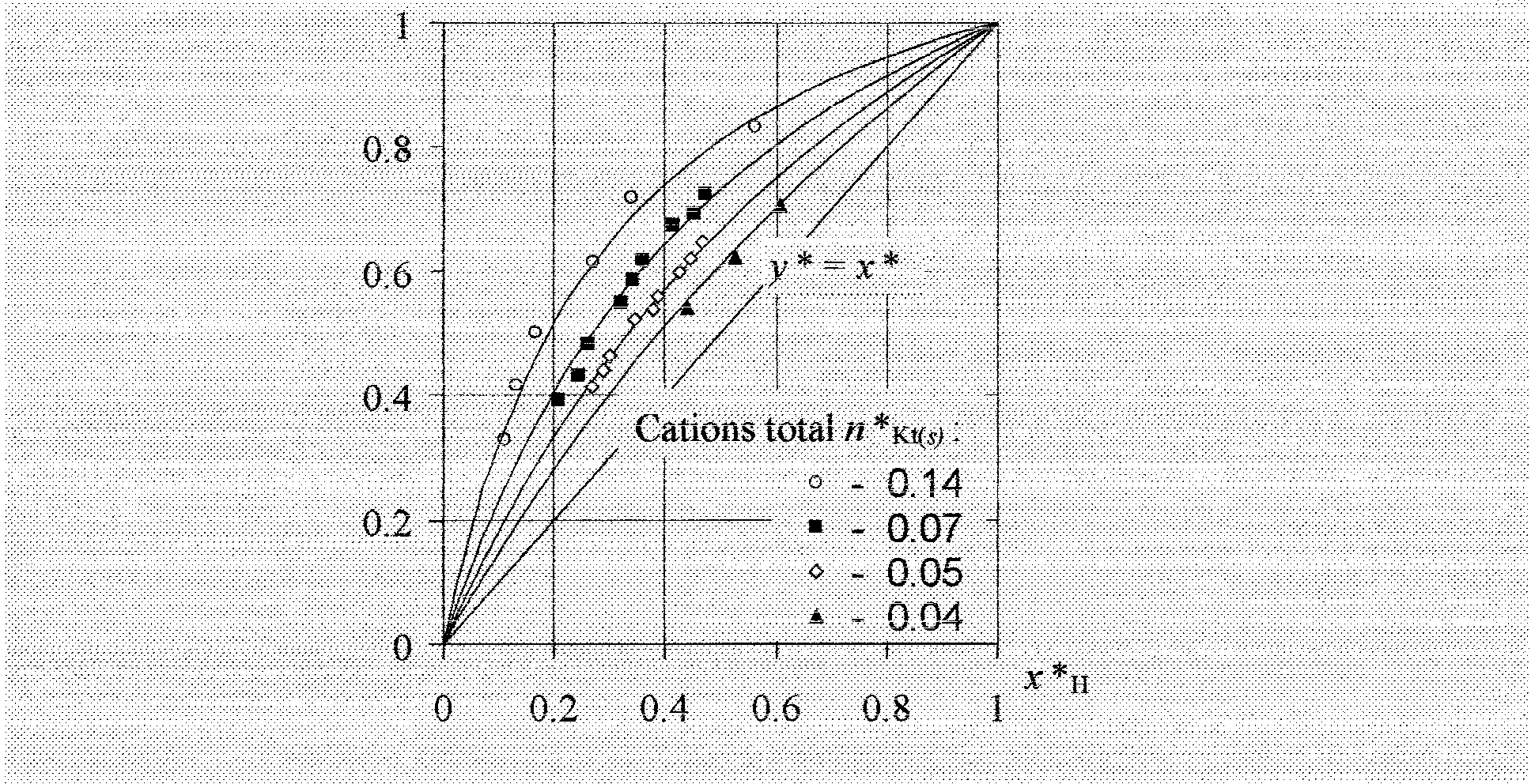
podziatu:;na podstawie udziału jonu w jonicie (y) i w roztworze (x):
P=y/x
. gdzie: x, y są odpowiednio ułamkami molowymi jonu w roztworze (x) i jonicie (y),
Dla jon6w::n$ej samej wJłrtościowości, jako względną miarę powinowactwa przyjęto wartość K AlB, zdefiniowaną wzofel1i:
KAlB =PB !PA
lub:
![]()
Równoważnikową stałą równowagi chemicznej K(gR)AiB, równą KAIR tylko dla jonów o tym samym ładunku, można opisać zależnością:
*
y
K(gR)AIB . x*
l + (K( gR) A/B -l) . x*
12
Krzywa ta jest hiperbolą
2
~
bl
". -
k ..
_ .uzy Kose l rząd rea eJl.
SZYlJtm~reakcjichemicznejhvyraża szybkość przybj"Nania lub ubywania składnika w wyniku przebtegu'reakcji chemicznej,·
n
Jednostkąjest masaJ(objętość*czas) (V" X t)lub (liczba moli)i(objętość*czas) (V X tJ, np.
T*iO' 1"n{··11"'t1ol fI 9 q
,~ :: .. _._ _ ~:~:.~_ _. _ ~ ....•.... _ ;) ----- --'-.- ).
'(rn3 X .9) (drr~3 X 8) (l X s') (l'n;~ X 8) (drn/j X 8) (l X S J CI to litr, g to gram, s to
\ "', ~, ", " , ,
sekunda).
Szybkość reakcji definiuje się pochodną stężenia po czasie. Dla reakcji
A.+B-+C+D
SZ'jbkość jest 'wyrażona tak:
![]()
.fr :r\ 1
cą Dj
---
dt
Jeżeli w ró\vnaniu występują współczynniki stechiometryczne, to będą występowa...1y także w mianowniku wyrażenia na szybkość - choć nie zawsze muszą im ściśle odpowiadać.
Z drugiej strony eksperymentalnie dowiedziono, że szybkość reakcji można \vyrazić tak:
v=k[At[B]m
przy czym wykładniki potęgowe nie wynikają z równania sumarycznego, a jedynie z mechanizmu reakcji, dokładnie z jej rzędowości. Dla prostych reakcj wykładniki te przyjmują zwykle wartości
13
całkowite, zaś dla reakcji złożonych mają \vartości ułamkmve. V.; tym wyrażeniu mogą występować produkty, lecz tylko w szczególnych sytuacjach. Łącząc te dwa zapisy dochodzi się do równania kinetycznego,
Stała szybkości reakc.ji to współczynniki ~;ystępujące \v równaniach kinetycznych, opisujących przebieg w czasie reakcji chemicznych.
W zależności od zewnętrznego rzędu reakcji chemicznej stała szybkości przyjmuje różne jednostki wg ogólnego wzoru:
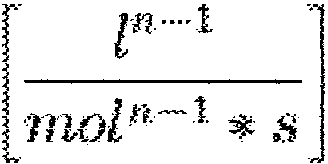
co daje następujące jednostJr..i dla rzędów od O do III:
fk,,;1
l .1 l" l
O rząd:
[k]
I rząd:
[kJ
II rząd:
gdzie: n - zewnętrzny rząd reakcji, l = litr, mol = mol, s = sekunda
\
'\!.łaćnip rll~tpo-n 7P st~b db -o' 7nvrh rAum~'; rp~t-('ii rn~ inn~ iprlno"tvp nnrl~jp "jp i~ n~i(,7Pć('ip; bpz
............................ -- ... ~ ... -ó~, L..<_ I;.i,..&...ii.~ ..•. ....., ..•. -~_U .. LJ .••....•...•...•..•.....• y...- .•...•. or.4L..ii. ..ii. _...c...ii."'-J.I. ..•...•..•. ~ ..•...•. A ..•..•. "'tJ'-"--.1..i.'""u- •.•. ..i. ••• ~, r'-"""'""~J- •...•..•. '"'ć J"t ..•. ..L~J-L.l"t'....,--"'-J ••....
jednostki.
Rząd reakcjito nazwa wartości \vykładników vlystępujących przy stężeniach związków chemicznych, w równa.'1iach kinetycznych danej reakcji chemicznej.
Istnieją różne rodzaje rzędó\v reakcji:
Rzędem zewnętrznym reakcji nazywa się sumę wszystkich wykładników, występujących w ostatecznym, sumarycznym równaniu kinetycznym danej reakcji.
,. Rzędem względnym (względem danego substratu) - nazywa się wartość pojedynczego wykładnika, występującego przy stęzeniu danego substratu. Rozróźnia się tu jeszcze dodatkowo rząd względny:
zewnętrzny - czyli vv'Ystępujący w ostatecznym równaniu kinetycznym
wewnętrzny - czyli występujący w równaniu jednej z reakcji elementarnych, z których w rzeczj"vVistości składa się analizowana reakcja.
nreUlnptr7ne rzędu u17o-1pdnp 'vuniv",;~ hp7nnćrprlnin 7 lir7hu (,7~dp(,7eV rl~npo-n Sllh"tr~tll
n BU,!:: .~ •• J n~b''!:: u_ H J,u'~"J"t ~-~ł'~~'-~'u~ ~ u_~~J -~"t~._-~ n ~~'-b~ ~~~ ••••• ~
uczestniczących \v pojedynczym akcie elementarnym i dlatego przyjmują one za\vsze \vartości całkowite - zwykle O, l lub 2.
14
C
"~ml'
zrl"H-7a «;1"
7e
,"zalprl1lv
r7ąrl U,If\""1etr7nv
ro'
Ulna «ię zeU7nętrz1'1p"11u rzed"nu,71' "77glpr1nelnu
- eo
U~.oL"" "-'l.Uł ••....• o-J.l..,=" L.J. Y''f e..&.~~ .... .] ..1. ••....• __ ...- _"'Y..l.~l:.L""""""''''''''J •.•...•. ..1. o..J.c. .•. ł' .•...•. L L..I._..I..L ..•. ..I.~~ '-JW" i"l' .••...• .L~ __ "" .••••.
świadczy o tym, że dany substrat uczestniczy w ramach danej reakcji tylko w jednym akcie elementarnym. Często jednak w końcowych równaniach kinetycznych występują rzędy ułamkowe, co wynika z faktu dużej złożoności mechanizmu takiej reakcji.
U stalenie rzędu zewnętrznego reakcji jest zazwyczaj bardzo proste i wymaga tylko wykreślenia zależności stężenia wszystkich substratów od czasu reakcji, a następnie dobrania do tak otrzymanych krzyvvych odpowiednich równań, zwykłymi metodami statystycznymi. Ustalenie rzędów
n7pUlnętr71'1Vrh J' p«t zn~1"7nip trurlnipi«7e i '~Hlman~ <1tnsnnl~ni!:ł uli pl" 7łn70nvI"h tpchn;tr r nn'
\","""' ••.•. J< iI,. L-LE...LJ-"" _ •..•...•.••..••. _ .••....•• ~_ ..I. ••.•... ~-J •....•.••.....•. ..1. "'".]..I..L oL&, •.••• L~· ~l'·YLa,,,,,..i; ..•. _ .•.•..•. __ ..•. "-4- LJ ••....•.••....• .i.. .]- .•. ~- ..•..••.•. ..i. .••.•. 1. , ..•...•. .t'.
znakowania izotopami) ale jest częst~ konieczne do pełnego zbadania mechanizmu danej reakcji.
Np: \10./ poniższym rÓ\A/l1aniu
![]()
![]()
Gdy można opisać zmianę stężenia substratu A równaniem:
d[AJ
3t a
I, [/1JO ~. f~~
h· j-"i - ••.
to względny rząd zewnętrzny dla substratu A wynosi O; gdy stężenie to zmienia się zgodnie z równaniem:
d[A] = k[AJl dł
to \vzględny rząd ze\vnętrzny dla substratu i\ ~~rynosi 1; gdy popra\vne jest ró~~x/nanie:
..srAl
u:l"" "'J
dt
![]()
t
ulzalpdnu
r7!:łrl 7p,,,nptrznu db s"hstr<ltl! A
Ulunn«;
'j.
T
H7res7
•... ip gflv Zml·~nv stP7pn;<l s"h",tratr.UI II
•. 't ~"'ć .•. .l.J .•. .L.-'~ L-'~":".L ..•. "t:''"''''' ..i. ..•. J .i. •..• '-'I.OJ •.•..•. ~L_.t'\.. ...-TJ ..•..•. 'O.J".....- ..•. MJ, --.. "'t..i. .••.••. _ ..•. _, .••.•. .1 .i. ..•..•. 1l4--l-..t..j ••. ~ .••.••. _ ..•. ..I...L~ __ '-.ił •...•••.•.•.•••. "-'TY ..••. .l-\..
i B są zgodne z równianiem:
![]()
![]()
to wówczas względne rzędy zewnętrzne dla obu substratów są równe 1, zaś rząd zewnętrzny całej reakcji wynosi 2.
![]()
24.Reakcje II rzędu.
15
![]()
![]()
![]()
- .I.i \,
f
{
"-'a
J
A.exp \- RT/
gdzie:
k - stała szybkości reakcji
A ~ stała dla danej reakcji, zwana też czynnikiem przedwykładniczym
Ea - energia a.1ctY'Nacji
R - (uniwersalna) stała gazowa
T - temperatura
lnk
lnA -
![]()
(1\ t mm ) l-T'
\_ .. - "."I
Znając doś\viadczalne wa..rtości stałych szybkości reakcji \"1 kilku temperaturach, można łat\vo \vyznaczyć zaróvv'110 stałąA, jak i energię aktywacji dla danej reakcji.
"6 A h~ovn~iq ; a~~ vn ; •• "= • lL"-""'''''' ł""J"'" u",o .• pCJU.
Absorpcia, jest to przekształcenie energii promieniowania wskutek oddziaływania z materią
(
rhłan'",nl'p.\
HlI'nnp. f'nrmu enp.rn'l'
• "" .ł.u".u .••••• ) Y'i 1.i..iJ.. ••••• A.-'ł.J.l..ł..u.,] .i..i •.••• "..i.5..l.
Proces polegający na wnikaniu cząsteczek, atomów lub jonów do wnętrza innej substancji tworzącej dowolną fazę ciągła.
A
nrpc~a
- tn
prnrps- \'/'<>7"''''''' ",p
r7~"tpr7p.k atnillor
UT
lllh
J'n.,';UT.,<>
nou/,pr7rhn, l"h
nr<>n'c"
f<>7
'łJ .•••.•.•••.•• ,.,.. •••••.•• ..i.~L..I~..i..L..i.~ ~..i."'i::' "'""L..I'"'tU' •... __ L..I"'"" .••... , •... '-'..1. ..•.. v .•• ~1l,J V..I...I.o....; tt ••..•..•.••• ~_ .•••• ..i._.i.L< ••••.• .i...i...i...i...i. •.••••.••. ,:,./>\...0. • ..1...11.. .1 ..I.~
fizycznych, po\vodujący lokalne zmiany stężerJa.
2. gromadzenie się cząsteczek gazu lub cieczy na pow. innej substancji, zwykle ciał stałych. Jest skutkiem przyciągania molekularnego na powierzchni.
27.Adsorpcja fizyczna i chemiczna.
Adsorpcja f"IZYczna lub mniej precyzyjnie fizysorpcja to zjawisko lub proces adsorpcji na skutek działania sił oddziaływania międzycząsteczkowego - sił van der \Vaalsa (z wyłączeniem wiązań chemicznych - wówczas mówimy o adsorpcji chemicznej, czyli chemisorpcji) pomiędzy cząsteczką adsorbatu a powierzchnią adsorbentu. Energia Z'vviązana z procesem adsorpcji fizycznej (ciepło adsorpcji) jest z reguły rzędu kilku H/mol (rzadko kilkunastu H/mol), poczas gdy VI przypadku
rłC1 •...••..•.•.•..••. "';; h ~ . ą+ "'u; tk .;1"; •....•. -r""7~A" ·.o.k '70 ( • pl o.."ł •...•. ;; .•...• ha ; '7'1"\0·) W; tk " AC" .•.•.•••• "- •.
a .•• ",v.yvp cuemlczn~l s .0 v •• e. O"'v' v u.''l'" vv'1y SŁ.v,-Cle .v rvaKvp vuvm.CŁ.u..;J .• e. OSC a .•• ",o.ycJl
fizycznej silnie zależy od temperatury oraz ciśnienia lub stężenia adsorbatu, a obniżenie ciśnienia lub pod"'Y'ższenie temperatury prowadzi do łatwej i szybkiej desorpcji,
Oprócz oddziaływań adsorbat-adsorbent w układzie takim istnieją zawsze zwiększające wielkość adsorpcji oddziaływania adsorbat-adsorbat. Jako tzw, oddziaływania boczne zwiększają wartość adsorpcji w obrębie monowarstwy adsorpcyjnej, prowadzą również do pojawienia się kolejnych warstw adsorbatu na już zapełnionej monowarstvvie - trw. zjawisko formowania wielowarstvv)' odpowiadające skraplaniu pa..ry cieczy przy ciśnieniu obniżonym na skutek przyciagających sił
- - - - -
adsorpcyjnych.
16
~;h, \Jan rlpr ''lT;Hd«~ 7~1e7>1 od· rOrl7>1;U1 nO'Ml'pr7r'hn; <>rl«f"'\rbpntu; <>rl«orh<>tu ;prlnak m<>;<> r'h<>r>1kter W
L.lLlJi.J ..•. L ..•. V\ IL.-L".L'-"_ ""'"-L .••....• -'"t - .•.. ~"'-"io.ł.J J.. -\i~ ""'..i. .••....• _..i...i...i. ~'-'i-L..1~.l. _.LL ..I.. iA,~"'" .LLtol...a. ,J-~.l.Jl '"'- .I..I..I.~J~ _.L.L~.L""".L &. .
rłU''';'''l:T'f''''ło'''ł ~+ 1"'\.1"'ł;'" ....,,~.Q 'f"'II. i"""'Th '"7" rrd-'l[T' '( 7 "k· ' •.•. d "'7 '"7TTC!t1r; "'7 .••••. "'(""tU'P7.Clt. hn.o.rrn. .• i-....,,; n" ;ł
UUL.yu. ,,.op'uu u.",spe",yuCL.uY, ES yZ wynl aJą prze WSL.Y" n...m L. pOVV"L.",CUU"'ESv lSuueula s.
dyspersyjnych (Londona) Z\viązanych z budową materii (dodatnio naładowane jądro i krążące wokół jądra ujemnie naładowane elektrony). Poza przypadkiem trwałych dipoli oraz wiązań wodorowych są również bezkierunkowe.
Arl«f"'\rnr';a f17"r'7na ;p«t ;prln"m 7e 7;<>u,;.,1, tu/"r7~r'Vr'h Y\l "um;e 7;<>Ul;d,f"'\ <>d"f"'\rnc'.il' a to f"'\"tatn;e
L.io..~L..7;;.j.Lł"'-J-· ..iL..tL..i..1_L..< ..•. ..i. J-Li •.. J __ i.LJ.L .•. .LL..l. "'-"JLc.. .•• y.6..u·.Llio.. LoYY'-".i:.~"t-.f-"'..i. ł'Y U -.l...i..L.I. ~t,.4ł'ł'..LW..l:.:ł..-~ •.••• '-"'-'L.t"' ~, L'J '-"I...T'" ..•..•. .L
;arł",u"" za .,.;"n';sk okres'lanych "Nspr..ln" n"~u" SO •..•... ,...;; (nazn'a nl'ezbyt •... ra,...yzy;"'a na~ua "'ba;""uJ'e
J\.IU1..lJ~'U \.I LlJUVY.l .1.1. V V.Iq .l(.ł..L.VY'ł:. .lpVJ.l u. vv -1.1. "p.l\.lV J.l.l 1.1. LV" V '"-'J.l.H
zjawiska adsorpcji, absorpcji gdzie mechanizmem jest podział objętościowy, zjawiska tzw. sorpcji wymiennej oraz inne w wyniku których określone substancje przemieszczają się z jednej fazy do drugiej z wytworzeniem pewnego stąnu równowagi).
C
'Qornl"iac-
<>dsorncia
Chpml' C'7na
pf"'\1pO'~;~r'~
n~
tU/orzpn1H
Sl"ę «l'1nych n1l"ąz<>n' Chpilll'czn"r'h
..... ".-a- ...•. 1' •... " 'i,..i,- .Lł':J .•. i"" .•. ...I.L _L...ł ., ••....•..•. -e-J"'t~- .•.. u •..••••• ",.L _..i..o:...i.ł,.,i. ~ .,1...1..1. - l'l' ~L ..I...L_..l..L .J '-01..1.
między adsorbentem i adsorbatem.
Aby usunąć chemisorbowaną cząsteczkę nie wystarczy silnie obniżyć ciśnienie lub stężenie adsorbatu, wystarczające w przypadku adsorpcji fizycznej. Należy jeszcze silnie podnieść temperaturę. VI niektórych przypadkach usunięcie adsorbatu może być niemożliwe bez destrukcji adsorbentu. Przykładem jest tlen chemisorbowany na węglu aktywnym po ogrzaniu wydziela się ale w postaci tlenków węgla.
Chemisorpcja jest adsorpcj ą jednowarstwową, co oznacza, że na powierzcr~11i adsorbentu może się zaadsorbować jedynie jedna warstwa (monowarstwa) adsorbatu, Jednak adsorpcji chemicznej zawsze towarzyszy adsorpcja fizyczna w obrębie monowarstwy oraz jako adsorpcja wielowarstwowa - na istniejącej chemisorbowanej monowarstwie. Adsorpcja fizyczna stanowi również ważny etap pośredni pomiędzy adsorbatem gazowym a chemisorbowanym.
Oddziałyv/ania związane z chemisorpcją są oddziaływaniami specyficznymi. Z\.viązane są z efektem
o
;.oni-nl'""i''I[T;'ł''\'![rm
(e+.o.tr+
Veaso""")
;
.o.+.o.k+.o.,""
; .•... A"l"ltr.t"'o'l[T;"""ll,""
(e+-.o.tr+
Tl.a.h"u,o,tr);
\ n '-':7
'l"\r'7l.l
•... adtrl"l ",,.łcoornl""';; .'" HU..,
Y)H Y
H
\ ,-",n... '- ..•. '" H'U • "''-'" '''''H
'HUUn..", Y)H Y'H \ ,-",n... '--''''LI
y'"
Uj, U
VV
P L.
J P
n..U
uu"
• P"'J'
jonów także z oddziaływaniami elektrostatycznymi.
28.Absorpcja z reakcją chemiczną.
2
.
T70r'ermv
T ,anomllira·
• ~- ~ ~ ol - ~b -~~ •
Izoterma Langmuira to podstawowa izoterma adsorpcji wprowadzona w 1916 r. przez lIvinga Langmuira, laureata nagrody Nobla w 1932 r.
Ta teoria kinetyczna zakłada, że adsorbat może tworzyć na powierzchni adsorbentu tzw. monowarstwę czasteczek oddziaływujących z miejscami adsorpcyjnymi (oddziaływanie "pionowe") a nie oddziaływujacymi(albo słabo oddziałY'.vującymi) ze sobą (oddziaływania "poziome"). Cząsteczki adsorbatu obecne w fazie gazowej uderzają w pm,vierzchnię" - prawdopodobieństwo zaadsorbowania rośnie wraz z dostępną wojną powierzchnią. Zaadsorbowane cząsteczki charakteryzuje pewne prawdopodobieństwo desorpcji (proces przeciwny do adsorpcji). Oba prawdopodobieństwa zależą od temperatury i wielkości energii adsorpcji. Wraz z ciśnieniem rośnie częstość uderzeń cząsteczek w powierzchnię, a wraz z ilością zaadsorbowanych cząsteczek maleje dostępna powierzchnia.
W założeniach równania jest: brak możliwości tworzenia wielowarstwy, stałość energii adsorpcji (powierzchnia energetyczni e jednorodna, czyli homogeniczna), zaniedby.valność oddziaływań bocznych.
równanie izotermy Langmuira
]{p
a =.a .. _u_._. __ u
m 1 + Ir(p
gdzie: a - adsorpcja rzeczywista, am - wielkość adsorpcji odpowiadająca zapełnieniu monowarstwy, K - stała równowagi adsorpcji, p - ciśnienie adsorbatu
17
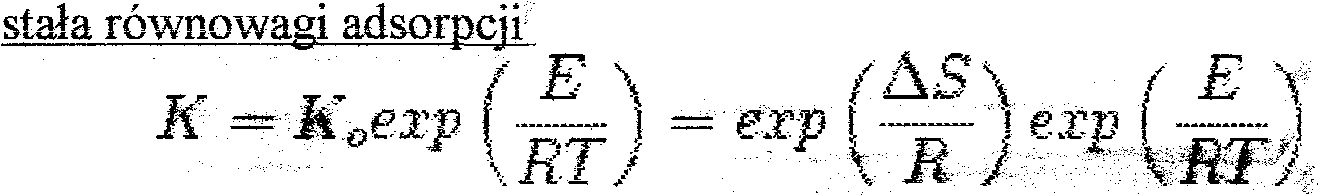
gdzie Ko to tzw. czynnik przedeksponencjalny albo czynnik entropowy, AS - entropia F adsorpcji, E - energia adsorpcji (ciepło adsorpcji) - w konwencji: dodatnia wartość oznacza wydzielenie się energii, w termodynamice przyjęte jest zwykle odwrotni~.
W
-baA"n;""j,.,
""A
adsorpc:ią
C'7i3"t" ll7<rnm "'ę pO,ięcl"a
1l7'7o-1ęrl"i3O"O "'''k'''ycl"e pOU7'er'7chn'
o'7n""za"ego
vu.,i.· LU.~JJ_ JJU1"..J. '.J L...i't'1.:J V UL...lY VYU ;.JI J V"L...i5J UJJVb- ł-IV j' \'VL _L... l , 1. Ld U""'" - - 1J -
e, które ma prosty sens geometryczny dla adsorpcji monowarstwowej:
względne pokrycie powierzchni
n
e = ... ',~ ...
€lm
T
"
dpfi",,,,,, polrmJcl"" nO'Vipr7f"hn, st",,,,'v"n"
ie"t iPrtn"le ro' ulnipz' 'lJ
l"nn\Jf"h
nr7un"rllrach
n' z'
..i; -L'-ł- •••.• L..Ł.Ł_J_ ..1.. J - -.t' - .~..I._ .•.••....• _ ..•. ..i...i. ..•. L •• ,--"v~V';jIL6"" &A.. J .•...... J-~'" ~ ..•. ~ ...-. -"'-"'- "' • ..I; J _.a. .t'.&.łL.Ji,] y •...•.. _..I.3>. - ..•...•..•.
adsorpcja monowarstwowa i nazywa się wówczas adsorpcją względną,
Dia niskich ciśnień róvmanie Langmuira redukuje się do izotermy Henry;ego dia niskich ciśnień:
![]()
R
'
'vnanie i70tpnnu T
·anomuir"
stan"Ul' •.• "rlst,,\UP uJUnr"ul"rl7pni"
ulipIu
l"nnul'h
rćnvn"ń i7"term, Ul
",. .•..•..•..•. .L.&....oI. L .•••...•. ..I..&..LJ.I..J t:::J .•...•...•. ~ l- LL'-.Jł'~.JŁ t'''-'"- ~-",v"t' •.. T,].t" ..•.••.••••• "-~ ••...• _ ..•..•....••. - v" .•. _ ..•. .L L.k.JV..L ..•. .a. ••....•. "' •. .L~.L.L .•.••••••...•...•. ..1. ..•. Vl'
tym izotermy BET oraz równań opisujacych adsorpcję na powierzchniach energetycznie niej ednorodnych (heterogenicznych).
'Inne postacie izotermy Langmuira
Jeżeli znamy wielkość pojemności monowarstwy (np. z innych badań), możemy używać inną postać izotermy Langmuira:
![]()
lub
p=
1
(
i
e \
.1=-0)
"'. ;'
J
p7ell"
znanaJ'est '''art" s' f.
n,,;pmn"s'
"i m"nO\l.l<łr"tUl"\J (nn z inmu"j,.,
badan'\ lin;ou1a .!""rm<ł 1"crarutmic7na
-~ .••...•...•...••.•.. F'V ..•••..••.••. __ .t''-'"J'''' ..•• .i..i..LV ~ ..••..•...•...•. _L.i.- "Y~U"'TYJ .i.ł"'" .L ..I.J-..I....I.. .LJ ..I...Ł ..•...•...•.. v\> l.L ..•...•...•. - ..L-b J •...•...•. ~ ~
jest przydatna Z'vVłaszcza do sprawdzania zgodności danych doświadczalnych z modelem oraz wyznaczania stałej równowagi K:
(
.
(;"
log- .. t ... ). = 10(.] 'D + lo~" J(
"-! ; B· -01: Q
l -
I
•..
"'''t"",~ l'n;ou,~ ''7'''+~rmv L""gmuI'ra
są p"'Uvs'7~~hn;i3 "t"''''''n'''n~ ,.l",
n
rH'7"aczanI'a parami3+rAn,
- .
.1 ł'Vi:J-U.",.lV -11.1- VVV.lL<VLTv!..i..lJ
U.l.l 1.
VV1
Li\v'-'.l.l.lViJvtJvvVU.1vu\JVV)L..._H 1..1'\.łL1.VVV
równania bezpośrednio z danych doświadczainych:
klasyczna postać liniowa (a1p)=f(p), podobna w swych właściwościach do liniowej zależnośi izotermy BET (jednak bez wieiowarstwy), stosowana m"in" do wyznaczania powierzchni właściwej adsorbentów:
ll) '\ .
, ." < 1
lU" ) = .um'"u"u·u, {l .7 ", \. a./ ,.'t} ,. '. - + I11) 'l
u'Tn \. ., f
![]()
• postać. 1inio'.l..la (l/a) = f(l/n\ "n"rl"hny~h \'ll,,~r.inl()~ci~ch i"le pop.r7pdni" 7,,1p'7n"~f.'
"" - .•...•...•. .L J J 1"'1 •...•. .t'''"'''_ . .....,,, ..•. - iV ..•. lL&<u_.L Y'Y .•...•• łJ .•• -- ..•...•. J- ..•. "". .L.J_ .L~_ L..ol_.L_L.l .•. .L ••....•••....•• _~
'j , 1 /. "
~ = ~ + ' (~)'
a arn [lm]{ \'P ...•
18
""'f"'I<,f",-' l;n;f"'Iul" " = f{aJ'n) •...• f"'I7ul,,1,,;"r" .ł"hun rlf"'lsft-·u.r ul<'7plL-;p f"'Irlrh"jpn;" <,"dpn,,,tyr7ne- od
ł"~LJL~V .L.L.L ..•.. ..L'-' •. ,,~ ~ .oL\. Y J Y'-"L..tł'ł'Lł,..LL.a.J'-t'""~ .Li.A.- ••.. ..- •.••..•.. _'-" i"LL...I."'-"_ •. "....,L..t_-'-..L:ł...L"" ••....•••...•. - .•..•. J .•. "' .•...•...•. <.N i-J)>...T •• ""..i. .•. ..L •.•.••••• - _,L.I .•..•.
modelu teoretycznego (ale dość vvrażlivva na rozrzut eksperymentalny):
iJ..
![]()
4 l __ \
l (U \ l-i" .. ;; j
.•.. ".",1---./
30.Izotermy Freundlicha.
Izoterma Freundłicha to równanie o chara.1cterze eksperymentalnym opisujące dobrze adsorpcję na
p
·erzch
•... ;a"'h h",+",rogen;cz •... ,,"'h (",
•... ", •. g",tvcz •... ;", •... ;",;",d
•... r"",,dnych) o •. az •... a .,Asorbentach
.lli.H '-'.H •••••. ,,\..1 .l .H.J'" \.1 .•• .1 •••••. .1 •••••. J .lli\,.; 1..l.lvJ •••••. .l.lV.lV .l.H au
mi kroporowatych.
Różne formy równania Freundlicha dla adsorpcji z fazy gazowej:
a= kpl/n
a = am(Kp)'1I
~ - ~ {n /p)m
Ci u - {,tm~ s
gdzie: a - adsorpcja rzeczywista, am - wielkość adsorpcji odpowiadająca zapełnieniu warstwy
a
"orp"'YJ'nP1
lub 7fłpp.łnl"enl"11
m;lrr"n"n'nAi k - «tała K - "tała r/nJVn"'XlaOl
ad""rnc,il" p - (,l~n;enl"e
i.,..i' ..oL •••••..•....•.. -J .•.... __ .....•..•. -s- .•. _ JLI .••••..••. JL..L"""'Y •••..•••..••.•••..••.•.•. ,. ..••••..•• , -.ił.- I.J .•. '-' .,,,,..i...i.'" '1'" bA. u ••...••.•. y 'J , _ ..•.•...•....•...•. ..Ic
adsorbatu, x = p/Ps - tzw. ciśnienie względne (Ps - ciśnienie pary nasyconej), n,m - empirycznie określone tzw. parametry heterogeniczności (m = lIn.s 1 - im wartość m jest mniejsza tym większa jest niejednorodność energetyczna układu adsorpcyjnego).
Równanie to stosuje się szczególnie do adsorpcji na mikroporowatych węglach akty"W'nych z rozcieńczonych rozt\-'/oró\v \;\lodl1ycll Z',,~viązkó\A1 organicznych - \"1 PO\\')!ższych rÓ'~lnaniach należy zastąpić ciśnienie stężeniem:
•
•
a = kcl/n a=am(Kcym
~_~ f~f~vn u - Um"-\.< I \.<s}
Należy zwrócić uwagę na fakt, że ograniczonej zgodności danych adsorpcji z równaniem izotermy Freundlicha można ocze}rj\vać dla praktycznie dovlOlnych układów eksperymentalnych (przybliżenie .r"agmentu tr •. ..,.,T\"",; "A",; •.• tr;"'m p""ste;) l\.T;",lr+,; •. ", ;..,."+",......,,, t"'orety"'zne "O' '''ll;'''';' •. aAnku;ą s;'" do
-L..L ..l n..J.L..J vV\".rJ vU\..r'.l.l.U"L..L\".r..L..L ..LV ~. i".l\".rfi-LV.l\".r .lL..VL-'-'.l.l.l.lJ '-' '-' .l vv ll\".r-L.. .l\".r\ •. &.l,U"L J .l'r
izotermy Freund1icha (np. izoterma GF dla niskich stężeń). W ramach teorii adsorpcji zlokalizowanej na niejednorodnych energetycznie ciałach stałych izotermie Freund1icha odpowiada eksponencjalnie malejąca funkcja rozkładu energii, f(E) = A exp( -mE), jednak w przeciwieństwie do równań opartych o monowarstwowe równanie Langmuira, izoterma Freundlicha nie zawiera ograniczenia wielkości adsorpcji monowarstwą.
T
~ -
-;_ .. ~--~ _.!..
>-~-;~ I
~ -' ... ;~-'- _~.n_~
n ~~~...l_;
_;~ <-~~_~+"'~~
~ _" • 1
<- ~-'"
V e111puyvL.UC IVvYlla.i1i<;;; Zl1a.azlo lOWniCL.pCWiI<;;; UZaOl<l.UIHeUiC LCVi<;;;tYVL.n<;;; W raInaCn Lev1l1
potecjałowej Euckena i Polanyi'ego oraz teorii objętościowego zapełniania mikroporów (TOZM) Dubinina i Raduszkiewicza (zob, izoterma DR). wIoże być również uważane za jedno z rozwiązań całkowego równania Stoeddiego. Vv ramach tych teorii równanie Freundlicha opisuje adsorpcję w mikroporach o określonej strukturze i PO\Vil11l0 być przedsta\vione jako:
nd7;p. <l - no,iemnos'c' nu·L-'>"p •• ,.;"'M (pO'PH1I"lO-SC' <lrlsorncYJ"na - nip rnyi1C' z Ob,iętt,-Sr," \ R1-
b ~.L_."O ł" J ..•...•. .L'" .&."10...1. .••••••••.•••••.••.••• Y J_.L.L.I..L OJ -~.I..t" .L .&..1..1.- ••. .1..1. .."-,L J .••...• 1oJ_..I.'t),--
parametr strukturalny, po - ciśnienie przy ktÓrym mikropOiY zostaną całkowicie zapełnione (z reguły niższa niż ciśnienie pary nasyconej), R - stała gazowa, T - temperatura.
19
W układzie logarytmicznym (!ng(a) od Ing (c» dane adsorpcji zgodne z ró\vnaniem Freundlicha układają się wzdłuż linii prosteL co pozwala na b. łatwe vvyznaczanie parametrów równania i opis układów doświadczalnych z pomocą 'wyznaczonych parametrów.
31.Izoterma BET.
Izoterma BET czyii izoterma Brunauera, Emmetta i Teilera to prosty model adsorpcji wielowarstwowej z fazy gazowej (pary). W modelu zakłada się, że cząsteczki adsorbatu adsorbują się na powierzchni adsorbentu w sposób zlokalizowany (tzn. cząstec7k-,i pje mogą się przemieszczać po powierzchni - patrz izotenna Langm\lira) dzięki oddziaływaniom adsorbat-adsorbent. Na
7>l"rl"rwhrnu<lnul'h l'7"dpl'7k-<>rh r17ip.1.T; nrlrl7;<>l"U/<>n;nm <>rl"nrh;:;t _<>rlsnrh;:;t (n1rn~"lnn"m nnnr7ez
4.<_ •...••• ~W~...LolJ~ł"ł'Lł,. ..•. ...L)_.L ..•• _""'-"~'-"'''''_'''''L.4'''''''-i,..C,'''''''',L ~.L-.l"""'t" . ..L"'-..L ~~'-'L..<""Lł,.""J •. .,IL.-I,..L.L.L'-' .•. .L...L Lł,.~"""'''''''.LL.'"''''''' i..O;,~ -~..LV"",,,,, \~.i."-...1. ••.... u ••. ~.L...LJ.L.L..I. t"'-'t-'.LL-<
"ll"elko"c' cl'epła slT ... npln •.• ~n nA"'o"'bnł-n\ mogą s~~ •••... l·on""!" •• nd·"''''''t...""",,; lTol~;"'e c~ą"'+eczkl' nA",,, •. t...a+u
vv ~ .I\....l.Q. .lUll.la. aui:t l ULU}.1 .ty I:-' lVvvV a. ;::'V.lvvvvav nr... \..tJił. L i:tL UUi:tVIV L
itd. Tak sformułowany model z reguły przewiduje adsorpcję wyższą niz obserwowana doświadczalnie. W ogólnym przypadku otrzymujemy równanie 3-parametrowe (ograniczenie grubości warstwy adsorpcyjnej do n-warstw, np. poprzez ograniczenia wynikające z wielkości porów lub rozmiaru przestrzeni międzyziarnowych). Po upraszczajacym założeniu, że ilość warstw adsorpyjnych może nie być niczym ograniczona, otrzymujemy 2-parametrowe klasyczne równanie BET.
Pomimo prostoty niezbyt realistycznych zalożei1, model ten właśnie dzięki swej prostocie osiągnął wielki sukces, stając się podstawą analizy powierzchni ciał stałych (niezbyt dokładne określenie "powierzchnię właściwą określono metodą BET").
Róy/nanie izotermy BET (dla nieskończenie \Xlielu ,~varst\Xl adsorbatu):
![]()
rr i.,-, - Ltj ,-,,)'1'1
1
1
~,
~~
![]()
\
Itr J( 'kl )
/' " postac asyczna
{:; t··, vBET(X}
![]()
1
1
-
"}'
..<..
" ~ >' ,.' •. ' J \,
. [R.f/(l-x) )
( 1. + [K x/ (1 - ~,)] .. (postać przekształcona)
gdzie:
e X = p/Ps - ciśnienie względne (ps - ciśnienie pary nasyconej)
e - tzw. pokrycie powierzchni (inaczej adsorpcja względna); w modelu adsorpcji wielm:varstwowej należy je traktować jako wielkość statystyczną, która może być większa od 1
am - pojemność monowarstwy
• K - stała równowagi adsorpcji (najczęściej używa się tutaj symbolu C) Równanie izotermy BET dla n-warstw adsorbatu, postać klasyczna:
![]()
![]()
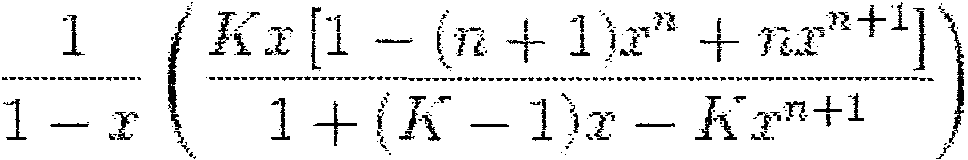
gdzie:
e n - maksymalna ilość \varstw tworzących się przy adsorpcji
Klasyczne róvmanie BET po przedstavlieniu w postaci liniowej stanowi do dziś podstawę analizy powierzchni właściwej adsorbentów,
Klasyczna liniowa forma równania BET:
20
.]:'
![]()
![]()
+
. J'" '1'
i.' ol - j
~." ...L ;'
-----T
. J::-!'I' '", •••.
11,;y, l'\,
gdzie a i x są dostępne z doświadczepja.
Dane adsorpcji (w metodzie standardowej \vykorzystuje się dane adsorpcji azotu w temperaturze ciekłego azotu, tzn. 77-7SK) wykreśla się we v/spółrzędnych tego równania w zakresie ciśnień względnych x od 0.05 do 0.04. Jeżeli stwierdza się znaczącą nieliniowość ogranicza się stopniowo zakres ciśnień względnych aż do uzyskania liniowości, np. do 0.1 - 0.25.
'-- - "" -- , ..•.
Na podstawie wartości parametrów dopasowania linii prostej do danych doświadczalnych \vyznacza się parametry am i K. Z reguły parametr pojemności monowarstwy adsorpcyjnej, am, jest zgodny z inI-1"".,i mptotiami (rA7nipp t"7<lti1zo ,w7pkr<lp7<l;ą 'Jn0/"j \;.t!Olła ,'AU/ni"\U7!Olcri !Olti"ornp.;; K f.h,h r)
............ J .•..•. ..l.t. i..l.L"'-'L~'-'I. ..I...I..&..1. , ..•. ~..::.....i. ..•. .i.V"" .i.L.Ji.j(,_.Li-~ .t'.LL..,;_.L •••....•. ~'Óo.iL.J..."J ~ •...•. ; U'J" Jo....JL~..1. L~ "T.i-A-·~ W'Y~b"" ,....,'-A.L.J'~..L.t'''''JJ. -A. \.J..L.4ł.J' "-/
'I 7'(1'7 r' r'\ t +AA~""ł'n";'o. ~ -' 'l"'lTa+ '""ITI'l: .•..•••.• -', • .ar. I'}; r- ;a.CI+ b 7~r\.rt.a. .a"nC!l1 -h"7'Tf"'7 fir\. ~ mA' e
V\ y L.na"ZUna ą meLUU<t H'OL." rrnec na vv "L VV LU LOSC uJ ,,111n<t, "o J""L poz av'i 'UH" S"H"U HL. y "L.nesU < <HUZ
być uważane za artefakt metody dopasowania. W rzeczywistości tego rodzaju rozbieżności mogą się pojawić w przypadku adsorbentów silnie niejednorodnych (heterogenicznych) lub mikroporowatych. Metoda BET nie jest w stanie prawidłowo opisać całego przebiegu izotermy adsorpcji dla takich danych, jednak prawidłowo oddaje przebieg izotermy w obszarze Krytycznym dla wyznaczania am.
Otrzymaną pojemność monowarstwy przelicza się na powierzchnię właściwą adsorbentu przy
,,, •. l'~--"~+n~:u H'nrt~!'c: +_n. -~W-l·"'rzn1-..~: ~:n"'n~;a n7n~+",n_l.; az~+" (r,: - f\ 1'::'" -m2) 'T'"L· nl~~!'l~-a ,.Y1\.V!Ly;jtUlll wa~tu,:, l LLW.!lU "'~ ""HIll MUUUllI ""~4;jt"'''''L1\.I ULU v -~ \.J.1.V':' HlI . 1....n. UlUc;':'lVll.
powierzchnię właściwą często nazywa się też skrótowo powierzchnią BET adsorbentu.
![]()
Fe + S = FeS
Fe -+ Fe2+ + 2e-
S + 2e- ~ S2=
Reakcje, w wyniku k-tórych dochodzi do zmiany wartościowości (stopnia utlenienia) pierwiastków nazY1-vam_y reakcjami utleniania - redukcji lub reakcjami red~oks (\\7 językl.l angielskim sło~y~/o oxidation oznacza utlenianie, a słowo reduction oznacza redukcję).
Reakcje red-oks
jako reakcja chemiczna,
jako reakcja elektrochemiczna.
![]()
,. R
![]()
![]()
Reakcje utleniania i redukcji
zachodzące z udziałem elektronów wymienianyCh z przewodnikiem elektronmvym - elektrodą nazywamy reakcjami elektrochemicznymi.
Deakci>lllt1enl'all11"a ~Ilh"t<>ncii na" po'W- jp,17chni elektrorłv rIo"l" rI'A7We rp>lkcjj allodowei a p,lpktl'o-Q'a li>l
1'\.' '~-..ł- - •• ---~'='-J' . '-'--'~~ . ~. ~-J • ~~ • UL. L • __ n-r :.I' -~-~~. ~-
której zachodzi proces nazywamy anodą. Reakcją redukcji nazy~wa się z kolei reakcję katodową, a elektroda na której zachodzi katodą.
21
Wyszukiwarka
Podobne podstrony:
32 piątek
32 sobota
od 24 do 32
32 pozyskujacy uczniow sluga bozy
32 Przepustka
ei 07 2002 s 32 34
PAG 32
09 1993 27 32
32 metoda pośreniego pomiaru długości
32 model małżeństwa i rodziny w XVII i XVII wieku, kulturoznawstwo
Unia Europejska t1.32, Wspólna polityla rolna
32. Małopłytkowość, MEDYCYNA VI rok, Pediatria, PEDIATRIA CAŁOŚĆ, Ustny PEDIATRIA Balwierz
Nr 32 BRĄZOWA
32 Dramat w okresie pozytywizmu i Młodej Polski (na tle dramatu europejskiego)
32 Geomorfologiczna charakterystyka wybranych obszarów Polski
32 oryginał
32 Swietlinska Outsourcing procesow
3 (32)