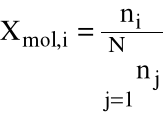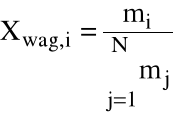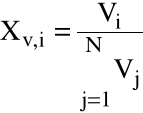Przypomnienie: stężenia |
Ułamki
Ułamek molowy:
|
Ułamek wagowy:
|
Ułamek objętościowy:
|
|
|
|||
Stężenia procentowe
procent molowy: %mol.=Xmol,i.100%
procent wagowy: %wag.=Xwag,i.100%
procent objętościowy: %vol.=Xv,i.100%
|
Stężenie molowe (molarność)
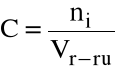
(gdzie Vr-ru jest wyrażona w dm3)
Stężenie molalne
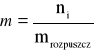
(gdzie mrozpuszcz jest wyrażona w kg)
ppm, ppb: części (wagowych lub objętościowych) substancji rozpuszczonej na milion (ppm) lub miliard (ppb) części roztworu.
Pytanie: |
Jaki jest związek ułamka objętościowego z ułamkiem molowym w mieszaninach gazów?
![]()
Przypomnienie: pojęcie pH |
pH (power of hydrogen) jest wyznacznikiem kwasowości roztworu.
pH = log10aH+ log10[H+]
W wodzie skala pH zawiera się w granicach 0 do 14 (skala paH).
(W innych rozpuszczalnikach może być inaczej!).
Przypomnienie: równowaga chemiczna |
Jeśli reakcja może biec w obie strony (reakcja odwracalna), to jej szybkość w każdą z tych dwóch stron z osobna zależy zwykle od stężeń substratów. Np. dla reakcji:
3H2 + N2 2NH3
prędkość "w prawo" wynosi: v= k[H2]3[N2]
zaś prędkość "w lewo: v= k[NH3]2
(k i k - stałe szybkości reakcji).
Stosunek stałych szybkości też jest wielkością stałą - charakterystyczną dla danej reakcji. Jest to stała równowagi:
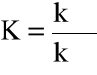
J. Gliński, w. 2
Wyszukiwarka
Podobne podstrony:
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
W09s-Amfoterycznosc, chemia, szkolka
zad. kompleksowanie, chemia, szkolka
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
zad. il. rozpuszcz., chemia, szkolka
zad. redox - potencj., chemia, szkolka
Zadania- stezenia, School, Chemia
W10s-rownowagi heterogeniczne-Iloczyn rozpuszczalnosci, chemia, szkolka
zad. statyst., chemia, szkolka
W04s-analiza nieorganiczna jakosciowa, chemia, szkolka
6.Stężenia molowe, Chemia ogólna ćwiczenia
potencjometryczne pomiary ph, Chemia fizyczna, laboratorium, Chemia fizyczna
steżenia I, semestr 1, Chemia, teoria
wyznaczanie krytycznego stężenia micelizacji, Chemia fizyczna, laboratorium, Chemia fizyczna
rozpuszczalnosc i stezenia, Nauka, CHEMIA, Szkoła, Chemia ogólna
W05s-analiza subst. naturalnych, chemia, szkolka
więcej podobnych podstron