Słabe kwasy wieloprotonowe i zasady wielowodorotlenowe |
Weźmy dowolny kwas wieloprotonowy. Jego dysocjacja elektrolityczna przebiega stopniowo:
etap 1 |
H3PO4 H+ + H2PO4 |
etap 2 |
H2PO4 H+ + HPO42 |
etap 3 |
HPO42 H+ + PO43 |
Wszystkie te reakcje dają ten sam produkt, więc cofają się nawzajem. Zwykle najsilniejszy jest pierwszy z tych procesów, a więc można traktować ten kwas jak jednoprotonowy, którego pKa=pKa,1.
Przykład: oblicz pH 0.1 M H3PO4.
pKa,1=2.2, pKa,2=7.2, pKa,3=12.3
Traktujemy ten kwas jak jednoprotonowy o pKa=2.2, korzystając ze wzoru Ostwalda:
![]()
Zatem pH=1.6.
Zauważmy jednak, że stopień dysocjacji nie jest wcale mały (H3PO4 jest kwasem średniej mocy):
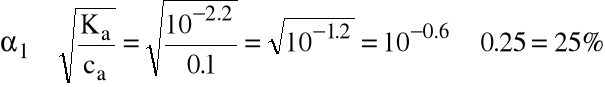
czyli nasze obliczenia są mocno przybliżone.
Należy też sprawdzić, w jakim stopniu pomijane przez nas wyższe etapy dysocjacji wpływają na pH.
Stopień II zachodzi w stopniu
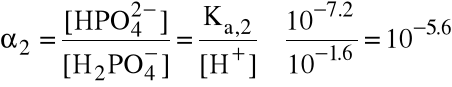
a więc stężenie jonów wodorowych wytwarzanych w drugim etapie dysocjacji wynosi co najwyżej
![]()
Jest to bardzo mało w porównaniu do wydajności pierwszego etapu.
Bufory |
Bufory to mieszaniny słabego kwasu (zasady) z jego (jej) solą z mocną (mocnym) zasadą (kwasem). Z punktu widzenia teorii Brnsteda bufory są układami zawierającymi dość duże (i porównywalne) ilości słabego kwasu i sprzężonej z nim zasady.
Dodatek pewnej (niezbyt wielkiej) ilości kwasu lub zasady w małym stopniu zmienia pH buforu.
Przykład: Weźmy bufor kwaśny (octanowy) - mieszaninę CH3COOH i CH3COONa.
Układ zawiera niezdysocjowaną postać kwasu octowego (kwas Brnsteda) i jony CH3COO (zasadę Brnsteda). Sole dysocjują całkowicie, więc [CH3COO]csoli. Obecność jonów CH3COO silnie cofa (i tak słabą) dysocjację kwasu octowego, więc [CH3COOH]ckwasu.
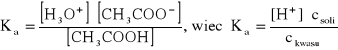
Stąd ![]()
czyli ![]()
Zamiast stężeń molowych można (a czasem jest wygodniej) używać liczby moli kwasu i soli.
[H+] buforu zależy od stosunku stężeń składników. Oznacza to, że bufor można rozcieńczać bez zmiany jego pH.
Bufory - działanie |
Dodatek kwasu (czyli jonów H+) do bufora powoduje ich reakcję z zasadą (w naszym przykładzie są nią jony octanowe). Ich ilość zmniejsza się o tyle, ile kwasu dodano. Jednocześnie zwiększa się, o tę samą wartość, ilość formy niezdysocjowanej kwasu. Jeśli bufor zawierał nCH3COOH moli kwasu i nCH3COONa moli soli, a dodano nHCl moli kwasu solnego, to [H+] wyniesie
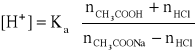
Podobnie dodatek nNaOH moli mocnej zasady zmniejszy kwasowość układu do
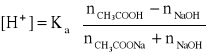
|
Przykład: oblicz zmianę pH po dodaniu 10 cm3 0.1 M HCl do 100 cm3 buforu, zawierającego 0.1 M CH3COOH i 0.2 M CH3COONa.
Bufor zawiera nCH3COOH=0.1 M.0.1 dm3=0.01 mola i nCH3COONa=0.2 M.0.1 dm3=0.02 mola
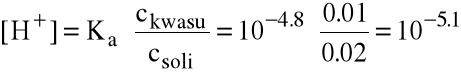
czyli pH=5.1
Dodano nHCl=0.1 M . 0.01 dm3 = 0.001 mola HCl
Kwasowość zmienia się do
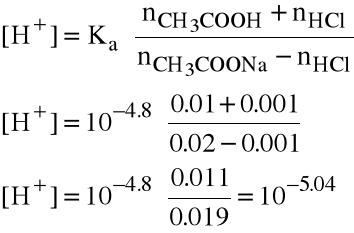
czyli pH spadło do 5.04 (zmieniło się o 0.06 jednostki).
Pojemność buforowa |
Bufor utrzyma w miarę stałe pH dopóki nie wyczerpie się jeden z jego składników: kwas lub zasada. Ilościową miarą "odporności" buforu na dodatek mocnego kwasu lub mocnej zasady jest pojemność buforowa:
![]()
(ndod. - liczba moli dodanego mocnego kwasu/zasady).
W szczególności pojemność buforową można zdefiniować jako liczbę moli dodanego mocnego kwasu (lub mocnej zasady), jaka zmienia pH buforu o jednostkę.
Pojemność buforowa jest zwykle różna dla dodatku kwasu lub zasady; te dwie pojemności są równe wtedy, gdy stężenia obu składników buforu są jednakowe.
Ogólny wzór na pojemność buforową* :
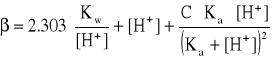
(gdzie C - stężenie słabego kwasu tworzącego bufor).
Wzór zawiera dwa wyrazy niezależne od charakteru buforu - określają one wzrost pojemności buforowej w obszarze silnie alkalicznym i silnie kwaśnym.
Poniższy wykres przedstawia zależność od pH dla 0.1 M CH3COOH. Dwa pierwsze wyrazy wzoru na dają wzrost pojemności na krańcach skali. Klasyczny bufor (układ sprzężony kwas-zasada) to dzwonowa krzywa o maksimum przy pH=pKa.
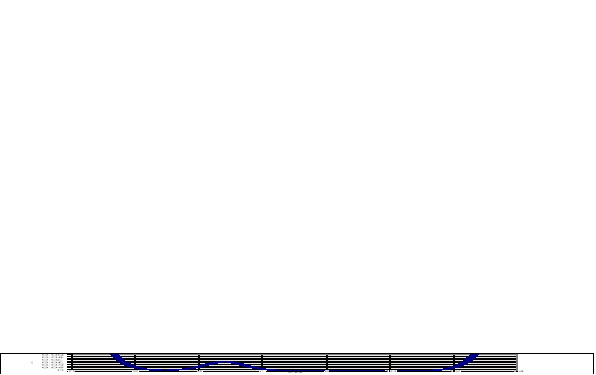
* np. A. Hulanicki, "Reakcje kwasów i zasad w chemii analitycznej", PWN 1979, str. 149. Nie trzeba pamiętać tego wzoru.
© J. Gliński, w. 8, p. 3
Wyszukiwarka
Podobne podstrony:
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
zad. slabe kwasy, chemia, szkolka
Chemia kwasy i zasady
Kwasy zasady wzór sprawozdania, Chemia
19264-kwasy zasady sole najważniejsze informacje, chemia
9.Kwasy i zasady, AGH różne, chemia wykłady
Wykład 13 Chemia Organiczna, izomeria, oddziaływania międzycząsteczkowe, kwasy i zasady 5fantastic p
kwasy i zasady
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
19311-tlenki i kwasy sole i wodorotlenki, chemia
W09s-Amfoterycznosc, chemia, szkolka
1 Równowagi w roztworach elektrolitów Kwasy i zasady
KWASY I ZASADY OZNACZENIE STĘŻENIA
zad. kompleksowanie, chemia, szkolka
więcej podobnych podstron