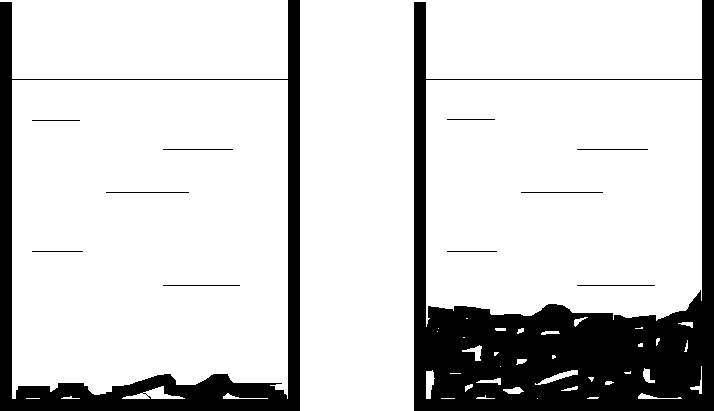
Równowagi heterogeniczne. Iloczyn rozpuszczalności |
Rozpatrzmy trudno rozpuszczalną sól MnAm w jej nasyconym roztworze.
Pomiędzy nasyconym roztworem a nierozpuszczonym osadem istnieje równowaga
MnAm nMm+ + mAn
Równowagę taką opisuje stała równowagi Kso = [Mm+]n[An]m
(Indeks so jest skrótem słowa solubility - rozpuszczalność. Niekiedy zamiast Kso używa się oznaczenia IR - iloczyn rozpuszczalności).
Zauważmy, że wyrażenie na Kso nie zawiera substratu reakcji (czyli soli MnAm). Oznacza to, że stan równowagi nie zależy od ilości osadu będącego w kontakcie z roztworem.
Niezależnie od ilości osadu, skład roztworu nasyconego jest taki sam. |
|
Iloczyny rozpuszczalności są stablicowane w postaci ich ujemnych logarytmów dziesiętnych, pKso:
pKso = log10Kso
Znajomość iloczynu rozpuszczalności pozwala np. obliczyć rozpuszczalność soli w wodzie.
Powróćmy do naszej soli MnAm i jej heterogenicznej równowagi MnAm nMm+ + mAn, dla której znamy wartość Kso. Z reakcji wynika, że stężenie kationów jest n razy, a anionów m razy wyższe niż wynosi rozpuszczalność soli. Jeśli więc rozpuszczalność soli MnAm jest równa r, to
Kso = [Mm+]n[An]m = (nr)n.(mr)m
Przykład |
Dla siarczanu barowego pKso=10. Oblicz rozpuszczalność tej soli w wodzie.
Skoro pKso=10, to Kso=1010. Reakcja równowagi na granicy faz
BaSO4 Ba2+ + SO42-
wskazuje, że w równowadze stężenia obu jonów są równe rozpuszczalności: Kso=[Ba2+][SO42-]=r.r=r2. Stąd:
r= ![]()
|
Równowagę heterogeniczną bardzo łatwo zakłócić.
Obecność jonów wspólnych w tworzonymi przez osad silnie zmniejsza rozpuszczalność. Jest to tzw. efekt wspólnego jonu.
Przykład |
Dla siarczanu barowego (pKso=10) porównaj rozpuszczalność tej soli w wodzie i w 0.01 M H2SO4.
Obecność nadmiaru jonów siarczanowych powinna cofnąć reakcję BaSO4 Ba2+ + SO42- .
Związek między rozpuszczalnością (r) a iloczynem rozpuszczalności będzie teraz następujący:
Kso=[Ba2+][SO42-]=r.(r+0.01)r.0.01.
Stąd r=1010/0.01=108 mol/dm3, a zatem rozpuszczalność BaSO4 w 0.01 M H2SO4 jest 1000 razy mniejsza niż w czystej wodzie.
|
Obecność jonów innych niż tworzone przez osad także zmienia rozpuszczalność. Wynika to ze zwiększonej siły jonowej układu. Jest to tzw. efekt obcego jonu. Dla jego zbadania wystarczy pamiętać, że w wyrażeniu na stałą równowagi powinny występować aktywności jonów.
Przykład |
Dla siarczanu barowego (pKso=10) porównaj rozpuszczalność tej soli w wodzie i w 0.1 M NaCl.
Obliczamy siłę jonową układu (pomijając jony barowe i siarczanowe, których jest niewiele):
=0.5.(0.1.12 + 0.1.12)=0.1
Liczymy współczynniki aktywności jonów Ba2+ i SO42-:
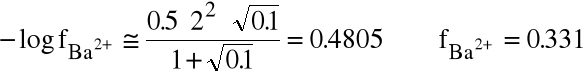
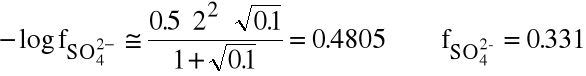
Związek między Kso i r jest następujący: ![]()
stąd 
A zatem, w porównaniu z czystą wodą, rozpuszczalność wzrosła około trzykrotnie.
© J. Gliński, w. 10, p. 1
Wyszukiwarka
Podobne podstrony:
Iloczyn rozpuszczalności(1), Chemia, Chemia nieorganiczna
zad. il. rozpuszcz., chemia, szkolka
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
Iloczyn rozpuszczalności, CHEMIA, semestr 1, chemia ogólna, wykłady
iloczyn rozpuszczalności, chemia
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
iloczyn rozpuszczalnosci, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
Iloczyn rozpuszczalności, Inżynieria biomedyczna, Chemia laboratorium
iloczyn rozpuszczalnosci, Nauka, CHEMIA, Szkoła, Chemia ogólna
Chemia Fizyczna iloczyn rozpuszczalności (2)
Chemia Fizyczna iloczyn rozpuszczalności (1)
Chemia ogólna, iloczyn rozpuszczalności
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci roztwo Nieznany
więcej podobnych podstron