Moc
elektrolitów
Dysocjację elektrolityczna ilościowo
charakteryzuje się za pomocą stopnia
dysocjacji
Podział
elektrolitów
Mocne
substancje które są
całkowicie zdysocjowane
-Wszystkie sole
-Mocne kwasy : HCl, HNO
3
,
H
2
SO
4
, HBr, HI, HClO
3
, HClO
4
- Mocne wodorotlenki : NaOH,
KOH, LiOH, Ba(OH)
2
= 100 %
HCl → H
+
+
Cl
-
Wszystkie cząsteczki
związku rozpadły się na
jony
=
Liczba cząsteczek
zdysocjowanych
Liczba cząsteczek przed
dysocjacją
100
%
Słabe
Substancje, które ulegają dysocjacji tylko
częściowo
HF H
+
+ F
-
Nie wszystkie cząsteczki
związku rozpadły się na
jony
Tzn. jeśli na początku były 4 cząsteczki HF to
np. 2 cząsteczki uległy rozpadowi na jony a
dwie nie.
Na początku 4 0 0
Po dysocjacji 2 2 2
HF H
+
+ F
-
Jeśli z jednej cząsteczki powstał jeden H
+
i jeden F
-
, to z dwóch cząsteczek które
uległy dysocjacji powstają dwa H
+
i dwa
F
-
.
=
100%=
50%
2
4
jest mniejsze od
100%

Słabe kwasy :
HCOOH kwas mrówkowy
CH
3
COOH kwas octowy,
HNO
2
– kwas azotowy(III)
H
2
SO
3
– kwas siarkowy(IV)
HF – kwas fluorowodorowy
H
2
S- kwas siarkowodorowy
Słabe wodorotlenki :
NH
3
H
2
O – wodny roztwór
amoniaku
Cu(OH)
2
– wodorotlenek miedzi
Zn(OH)
2
– wodorotlenek cynku
Patrz materiały do wykładu : Tabela. Stałe
dysocjacji
Miarą mocy elektrolitów słabych jest stała równowagi reakcji
dysocjacji
czyli
stała dysocjacji – która wyraża stan równowagi
między substratami a produktami
Do słabych elektrolitów
należą :
K
a
=
Iloczyn stężeń
produktów
stężenie
substratów
K
a
=
[H
+
]
[F
-
]
[HF]
a- acid – kwas
K
a
=
[H
+
]
2
C
HF
Jeśli :
[H
+
] = [F
-
]
[HF] = C
HF
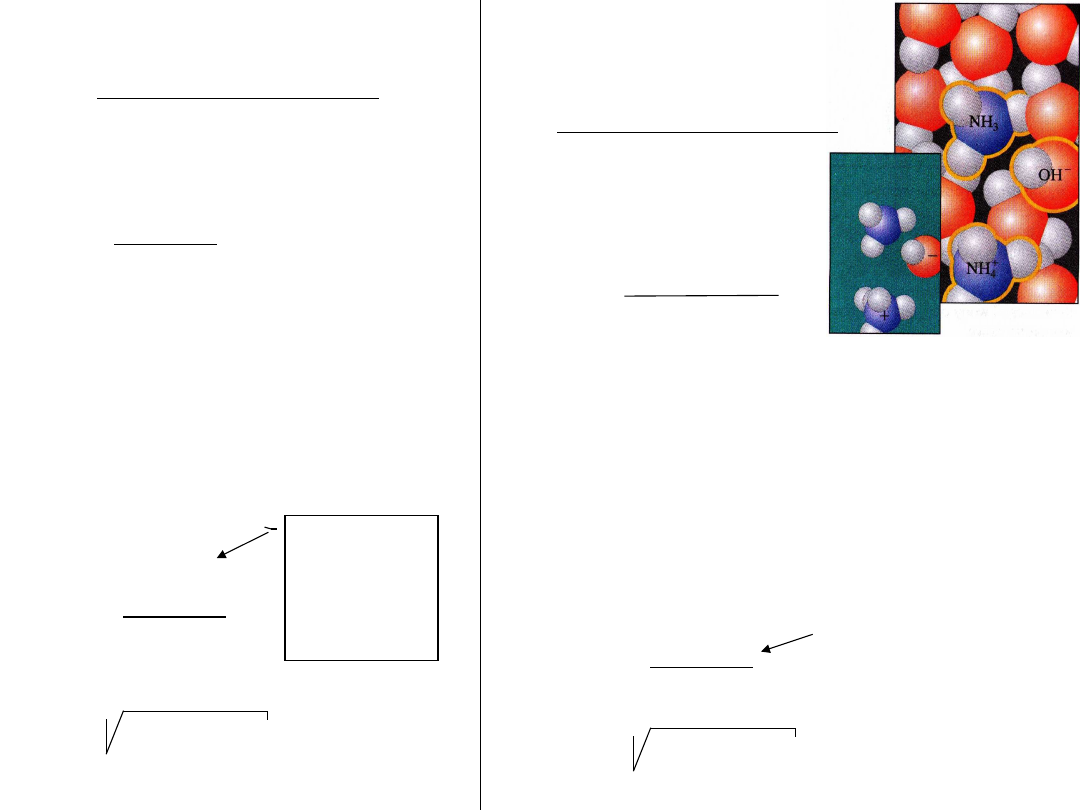
K
b
=
[NH
4
+
]
[OH
-
]
[NH
3
H
2
O]
b- base –
zasada
Jeśli :
[NH
4
+
]=[OH
-
]
[NH
3
H
2
O] = C
NH3H2O
[H
+
] – stężenie molowe jonów
wodorowy w stanie równowagi
[F
-
] – stężenie molowe jonów
fluorkowych w stanie
równowagi
[
HF] – stężenie molowe
niezdysocjowanych cząsteczek HF w
stanie równowagi
[NH
4
+
] – stężenie molowe jonów
amonowych w stanie równowagi
[OH
-
] – stężenie molowe jonów
wodorotlenowych w stanie
równowagi
[
NH
3
H
2
O] - stężenie molowe
niezdysocjowanych cząsteczek amoniaku
w stanie równowagi
K
b
=
[OH
-
]
2
C
NH3H2O
K
b
=
Iloczyn stężeń
produktów
stężenie
substratów
NH
3
H
2
O NH
4
+
+
OH
-
[H
+
]= K
a
c
HF
[OH
-
]= K
b
C
NH3H2O
HF H
+
+
F
-

Sole w wodzie- HYDROLIZA
pH roztworów soli rozpuszczonych w
wodzie
1. Sól posiadająca kation od mocnej zasady i mocnego
kwasu, np.. NaCl, KCl, MgCl
2
itp..
Wodne roztwory soli posiadają pH = 7 , czyli są
obojętne
2. SOLE pochodzące od słabych kwasów i słabych zasad- jeśli anion lub
kation pochodzi od słabego kwasu i słabej zasady.
Etap I – dysocjacja soli
KNO
2
→ K
+
+ NO
2
-
Etap II – hydroliza kationu lub anionu
czyli reakcja odpowiedniego jonu z wodą
NO
2
-
+ H
2
O
HNO
2
+ OH
-
Przeniesienie
protonu z wody do
jonu NO
2
-
W wyniku reakcji powstaje kwas
azotowy(III) i jony OH
-
, które są
powodem zasadowego odczynu
roztworu wodnego roztworu soli
KNO
2
Jon NO
2
-
pochodzi z kwasu HNO
2
który jest słabym kwasem.
2a. Sole zawierające aniony od słabych
kwasów
K
h
=
[HNO
2
]
[OH
-
]
[NO
2
-
]
Stała
hydrolizy
Gdzie : [HNO
2
] =
[OH
-
]
[NO
2
-
] = C
soli
K
h
=
=
K
w
K
a
[OH
-
]
2
C
soli
Przykład 2. sól kwasu mrówkowego HCOOK (od kwasu mrówkowego
HCOOH- który jest słabym kwasem i KOH – mocna zasada
1 etap dysocjacja soli HCOOK HCOO
-
+ K
+
2 etap hydroliza jonu HCOO
-
+ H
2
O HCOOH +
OH
-
Przeniesienie
protonu z wody do
jonu HCOO
-
Powstał kwas mrówkowy i jony OH
-
, które są powodem
zasadowego odczynu roztworu wodnego roztworu soli
HCOOK
2b. Sole zawierające kation pochodzący od słabych zasad - NH
4
Cl
1 etap dysocjacja soli
NH
4
Cl NH
4
+
+ Cl
-
2 etap hydroliza jonu pochodzącego
od słabej zasady
NH
4
+
+ H
2
O NH
3
+ H
3
O
+
Przeniesienie
protonu z jonu
NH
4
+
do wody
Powstał amoniak oraz jon H
3
O
+
czyli H
+
który jest powodem kwaśnego
odczynu wodnego roztworu soli
K
h
=
=
K
w
K
b
[H
+
]
2
C
soli
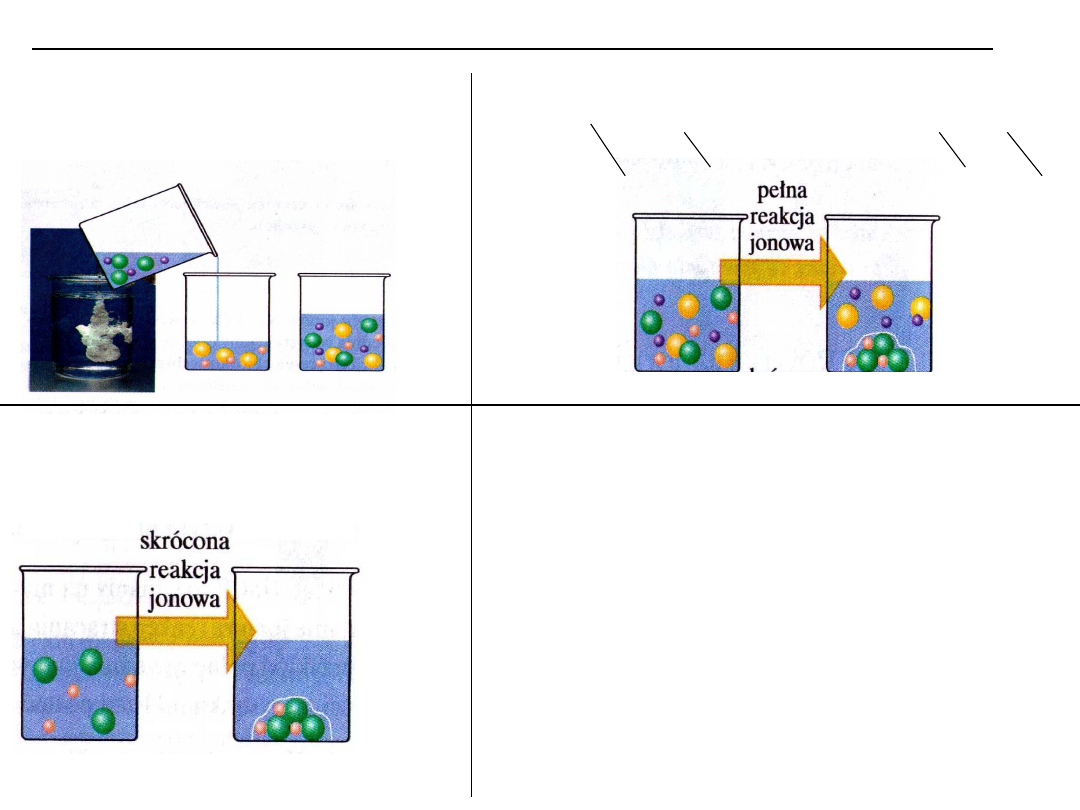
Reakcje strącania, iloczyn rozpuszczalności – równowagi rozpuszczania
Zapis cząsteczkowy
AgNO
3
+ NaCl → AgCl ↓ +NaNO
3
Zapis jonowy pełny :
Ag
+
+ NO
3
-
+ Na
+
+ Cl
-
→ AgCl ↓ + Na
+
+
NO
3
-
Zapis jonowy
skrócony :
Ag
+
+ Cl
-
→ AgCl ↓
Z powstałego osadu kilka jonów
zostaje uwolnionych.
AgCl Ag
+
+
Cl
-
Ustaliła się równowaga
między
nierozpuszczoną solą i
jej jonami.
K
s
= [Ag
+
]
[Cl
-
]
K
s
-stała równowagi reakcji
rozpuszczania zwana iloczynem
rozpuszczalności
[Ag
+
] [Cl
-
] oznaczają wartości
liczbowe molowych stężeń jonów
w nasyconym roztworze
Przykład 1. otrzymywanie AgCl

2AgNO
3
+ K
2
CrO
4
→ Ag
2
CrO
4
↓ + 2KNO
3
Przykład 2. Ag
2
CrO
4
Zapis jonowy skrócony :
2Ag
+
+ CrO
4
2-
→ Ag
2
CrO
4
↓
Ag
2
CrO
4
2Ag
+
+
CrO
4
2-
Powstały osad Ag
2
CrO
4
zaczyna się w
bardzo małym stopniu rozpuszczać (od
osadu oddysocjował jony które go
tworzą)
K
s
= [Ag
+
]
2
[CrO
4
2-
]
Document Outline
Wyszukiwarka
Podobne podstrony:
Hydroliza soli iloczyn rozpuszczalności
Wyklad 11b Elektrolity cd , hydroliza, bufory, iloczyn rozpuszczaln
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Iloczyn rozpuszczalnoÂci, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
iloczyn rozpuszczalnosci id 210 Nieznany
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci (Kso) Nieznany
Iloczyn rozpuszczalności(1), Chemia, Chemia nieorganiczna
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
iloczyn rozpuszczalnosci, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
Iloczyn rozpuszczalności
więcej podobnych podstron