Chemia, 2 rok studiów |
Julita Przeździecka Adrian Marzec |
Kielce 04.11.2009 |
Nr. 30 |
Iloczyn rozpuszczalności |
Ocena:
|
Wstęp teoretyczny:
Iloczyn rozpuszczalności jest stałą równowagi charakteryzującą roztwory nasycone, praktycznie całkowicie zdysocjowanych, trudno rozpuszczalnych związków. Umożliwia ona opis termodynamiczny procesu wytrącania osadów. Po wytrąceniu osadu trudno rozpuszczalnego związku AnBm, pomiędzy roztworem nasyconym a osadem ustali się stan równowagi dynamicznej, którą możemy wyrazić następująco:
AnBm=nAm+ + mBn-
Stan równowagi takiego układu zwykle opisuje się, wykorzystując pojęcie iloczynu rozpuszczalności.
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów danego trudno rozpuszczalnego związku w jego roztworze nasyconym w danej temperaturze i w danym rozpuszczalniku:
IrAnBm =[Am+]n[Bn-]m
Przez x oznaczamy iloczyn stężeń jonów związku trudno rozpuszczalnego w roztworze przy danej temperaturze i w danym rozpuszczalniku.
Jeżeli układ znajduje się w stanie równowagi dynamicznej to x=Ir i roztwór jest nasycony
Jeżeli roztwór jest nienasycony to x<I
Jeżeli roztwór jest przesycony to x>I i wtedy będzie się wytrącał osad aż do momentu, gdy x osiągnie wartość Ir
Im mniejsza wartość iloczynu rozpuszczalności, tym związek jest trudniej rozpuszczalny, a tym samym łatwiej wytrącić jego osad.
Wykorzystując wartości iloczynów rozpuszczalności związków, możemy przewidzieć kolejność wytrącania się różnych (trudno rozpuszczalnych) soli pod wpływem wspólnego odczynnika wytrącającego. W tym celu należy obliczyć, przy jakim stężeniu jonu strącającego rozpocznie się wytrącanie każdego z osadów. I wtedy jako pierwszy zacznie się wytrącać jon, do którego wytrącenia potrzebne jest najniższe stężenie odczynnika strącającego czyli jon tworzący z dodawanym odczynnikiem najtrudniej rozpuszczalny osad.
Kiedy wszystkie sole są tego samego typu, tzn. oddysocjowujące z 1 mola związku taką samą ilość moli jonów, wówczas określenie (oszacowanie) kolejności wytrącania (lub rozpuszczalności) związków na podstawie Ir jest stosunkowo proste. I w tym przypadku właściwe są zależności:
IrAB>IrCD>IrEF => RAB>RCD>REF
(R - oznacza rozpuszczalność związku)
Im związek jest trudniej rozpuszczalny, tym łatwiej go wytrącić
Wyróżniamy różnego rodzaju równowagi w roztworach elektrolitów:
Bufory- roztwory które nie zmieniają swego wykładnika wodorowego pH ani pod wpływem rozcieńczenia wodą ani przez dodanie niewielkich ilości kwasu ani zasady.
1.
Dysocjacja elektrolityczna- rozpad substancji na jony w wodzie lub w innych rozpuszczalnikach polarnych. Dysocjacja może zachodzić etapami- tzw. dysocjacja stopniowa.
Hydroliza - reakcja która zachodzi pomiędzy niektórymi jonami pochodzącymi z dysocjacji soli a cząsteczkami wody. Hydrolizie ulegają tylko te sole których jony mają zdolność reagowania z cząsteczkami wody. Do tego typu soli zaliczamy:
sole mocnych kwasów i słabych zasad - odczyn roztworu wodnego tych soli jest kwaśny
sole słabych kwasów i mocnych zasad- odczyn roztworu wodnego tych soli jest zasadowy
sole słabych kwasów i słabych zasad - odczyn roztworu wodnego tych soli jest obojętny
sole mocnych zasad i mocnych kwasów nie ulegają hydrolizie.
Dokonaliśmy kalibrowania konduktometru przed wykonaniem właściwych pomiarów.
Oznaczyliśmy przewodnictwo dla 0,1 M roztworu KCl
Wykonaliśmy pomiar przewodnictwa dla roztworu BaCO3 zlanego znad osadu. Następnie uzupełniliśmy wodą do kreski. Następnie umieściliśmy kolbę w wytrząsarce na 10 minut. Po upływie czasu wyjęliśmy naszą kolbkę z roztworem i po ustaniu się osadu, przelaliśmy roztwór i ponownie badaliśmy jego przewodnictwo.
Czynności w wyżej wymienionym punkcie powtarzaliśmy dla soli CaSO4 , PbCO3 , BaSO4, PbSO4 , SrSO4
pomiar stałej konduktometru:
Roztwory badanych soli:
przewodnictwo substancji rozpuszczonej:
wartość przewodnictwa właściwego:
stężenie:
iloczyn rozpuszczalności:
błąd pomiaru:
Cel ćwiczenia:
Wyznaczenie iloczynu rozpuszczalności z pomiarów przewodnictwa.
Wykonane czynności:
Opracowanie wyników:
Wyniki pomiarów zostały zapisane w tabeli numer 1.
Wartość stałej konduktometru obliczamy ze wzoru:
![]()
,gdzie
![]()
-przewodnictwo właściwe 0,1M KCl
![]()
- wartość przewodnictwa dla 0,1M KCl mierzona w konduktometrze
K- stała konduktometru
![]()
![]()
2.
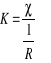
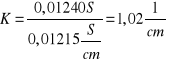
![]()
=0,000018S
![]()
=0,0000319S-0,0000018S=3,01*![]()
S
![]()
=0,00000598-0,0000018S=4,18*![]()
S
![]()
=0,000223-0,0000018S=2,212*![]()
S
![]()
=0,0000342-0,0000018S=3,24*![]()
S
![]()
=0,0000053-0,0000018S=3,5*![]()
S
![]()
=3,01*![]()
S*1,02![]()
=3,07*![]()
![]()
![]()
=4,18*![]()
S*1,02![]()
=4,26*![]()
![]()
![]()
=2,212*![]()
S*1,02![]()
=2,25*![]()
![]()
![]()
=3,24*![]()
S*1,02=3,30*![]()
![]()
![]()
=3,5*![]()
S*1,02![]()
=3,57*![]()
![]()
![]()
, gdzie
![]()
,![]()
-graniczne przewodnictwo równoważnikowe kationu i anionu
![]()
,![]()
-liczba kationów lub anionów w otrzymanych w wyniku rozpuszczania soli w wodzie
![]()
,![]()
- ładunek kationu i anionu
c- stężenie
3.
![]()
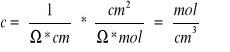
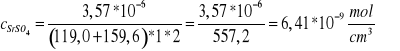
=6,41*![]()
![]()
![]()
5,50*![]()
![]()
![]()
7,05*![]()
![]()
![]()
5,35*![]()
![]()
![]()
6,28*![]()
![]()
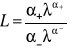
![]()
4,11*![]()
![]()
3,025*![]()
![]()
4,97*![]()
![]()
2,86*![]()
![]()
3,94*![]()
![]()
![]()
-99,9%
![]()
-86,25%
![]()
-54,81%
![]()
-40,41%
![]()
261000%
Wnioski:
Błędy, które wynikły podczas doświadczenia spowodowane są tym, iż w obliczeniach zastosowane są wartości literaturowe przewodnictwa granicznego równoważnikowego dla roztworów. Doświadczalne wyznaczanie rozpuszczalności substancji trudno rozpuszczalnych nie należy do zadań łatwych, tym też tłumaczy się pewne różnice w wartościach iloczynu rozpuszczalności, podawanych przez różnych badaczy. Ze stałej iloczynu rozpuszczalności można obliczyć stężenie jonów, a więc i rozpuszczalność danego związku.
4.
Błędy pomiaru wynikły z nie dokładności eksperymentatorów, nie dokładnie przygotowanych roztworów oraz z możliwie nie poprawnego odczytu wyników z przyrządu pomiarowego (konduktometru). Nasze obliczenia iloczynu rozpuszczalności znacznie odbiegają od rzeczywistych, literaturowych pomiarów. Przedstawiają się one w następujący sposób:
![]()
4,11*![]()
![]()
3,025*![]()
![]()
4,97*![]()
![]()
2,86*![]()
![]()
3,94*![]()
,
a pomiary literaturowe zapisane są:
![]()
![]()
![]()
![]()
![]()
5.
Wyszukiwarka
Podobne podstrony:
tabele, chemia fizyczna, Nowy folder, zalaczniki
Lepkośc, chemia fizyczna, Nowy folder, zalaczniki
Napięcie, chemia fizyczna, Nowy folder, zalaczniki
jonity, chemia fizyczna, Nowy folder, zalaczniki
Bomba, chemia fizyczna, Nowy folder, zalaczniki
db, chemia fizyczna, Nowy folder, zalaczniki
tabela 1, chemia fizyczna, Nowy folder, zalaczniki
zadatermochemia, chemia fizyczna, Nowy folder, zalaczniki
cząstkowe objętości, chemia fizyczna, Nowy folder, zalaczniki
Nernst(1), chemia fizyczna, Nowy folder, zalaczniki
kalorymetr, chemia fizyczna, Nowy folder, zalaczniki
Ćw. 17, chemia fizyczna, Nowy folder
Ćw. 20, chemia fizyczna, Nowy folder
Ćw. 29, chemia fizyczna, Nowy folder
Ćw. 16, chemia fizyczna, Nowy folder
Ćw. 14, chemia fizyczna, Nowy folder
Ćw. 13, chemia fizyczna, Nowy folder
Ćw. 21, chemia fizyczna, Nowy folder
więcej podobnych podstron