Chemia, 2 rok studiów |
Julita Przeździecka Adrian Marzec |
Kielce 27.11.2009 |
Nr. 5 |
Prawo podziału Nernsta |
Ocena:
|
Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie współczynnika podziału kwasu octowego między dwa nie mieszające się rozpuszczalniki- wodę i rozpuszczalnik organiczny chloroform.
Wykonanie ćwiczenia:
Przygotowanie roztworów kwasu octowego, w kolbkach miarowych o pojemności 50 cm3, o stężeniach 1,0M; 0,75M; 0,5M; 0,25M.
Do 4 rozdzielaczy odpipetować 20 cm3 roztworu kwasu z poszczególnych kolbek oraz dodać po 20 cm3 rozpuszczalnika organicznego (chloroformu) i tak przygotowane mieszaniny wytrząsać przez ok. 5 minut następnie odstawić do rozdzielenia.
Z pozostałych (w kolbkach miarowych) wyjściowych roztworów kwasu octowego odpipetować po 2 cm3 i miareczkować 0,1M roztworem zasady (NaOH lub KOH) wobec fenoloftaleiny.
Punkt 3 powtarzamy dla warstwy wodnej z rozdzielaczy
W tabeli 1 zestawiamy wyniki pomiarów miareczkowań warstwy wodnej kwasu octowego oraz wyjściowego roztworu kwasu octowego.
Opracowanie wyników:
Obliczamy dokładne stężenia kwasu octowego![]()
w wyjściowych roztworach i w wyjściowych roztworach i w warstwie wodnej układu: CH3COOH - H2O - CHCl3.
![]()
nz : nk=1:1
nz = nk ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Obliczenia dla kwasu octowego w wyjściowych roztworach:
dla 1M roztworu:
![]()
![]()
= 0,0181![]()
![]()
![]()
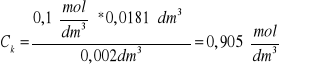
dla roztworu 0,75M:
![]()
0,0136![]()
![]()
![]()
![]()
0,680![]()
dla roztworu 0,5M:
![]()
0,0092![]()
![]()
![]()
![]()
0,460![]()
dla roztworu 0,25M:
![]()
0,00422![]()
![]()
![]()
![]()
0,210![]()
Obliczenia dla kwasu octowego w wodnych roztworach:
dla 1M roztworu:
![]()
0,0163![]()
![]()
![]()
![]()
0,815![]()
dla roztworu 0,75M:
![]()
0,0121![]()
![]()
![]()
![]()
0,605![]()
dla roztworu 0,5M:
![]()
0,00795![]()
![]()
![]()
![]()
0,397![]()
dla roztworu 0,25M:
![]()
0,00400![]()
![]()
![]()
![]()
0,200![]()
Na podstawie równania :
![]()
,
gdzie:
![]()
- stężenie substancji rozpuszczonej w wodzie (![]()
),![]()
![]()
- stężenie substancji rozpuszczonej w chloroformie (![]()
),![]()
n- liczba wskazująca ile razy masa cząsteczkowa ![]()
substancji rozpuszczonej w pierwszym rozpuszczalniku jest większa od masy cząsteczkowej ![]()
tej samej substancji rozpuszczonej w drugim rozpuszczalniku, wyrażana wzorem:
![]()
![]()
obliczyć stałą K.
Obliczenia dla kwasu octowego w fazie chlorowodorowej:
dla 1M roztworu kwasu octowego:
V=0,02 dm3
n1=C1*V
n1=0,905![]()
* 0,02 dm3=0,0181 mol
V=0,02 dm3
n2=C2*V
n2=0,815![]()
* 0,02 dm3=0,0163 mol
n3=n1-n2
n3=0,0181 mol-0,0163 mol=0,00130 mol
C3=![]()
C3=![]()
dla 0,75M roztworu kwasu octowego:
V=0,02 dm3
n1=0,0136 mol
V=0,02 dm3
n2=0,0121 mol
n3=0,0136 mol-0,0121 mol=0,000900 mol
C3=![]()
dla 0,5M roztworu kwasu octowego:
V=0,02 dm3
n1=0,00920 mol
V=0,02 dm3
n2=0,00790 mol
n3=0,0092 mol-0,0079 mol=0,00130 mol
C3=![]()
dla 0,25M roztworu kwasu octowego:
V=0,02 dm3
n1=0,00420 mol
V=0,02 dm3
n2=0,00400 mol
n3=0,00420 mol-0,0040 mol=0,000200 mol
C3=![]()
Obliczenia liczby moli:
![]()
![]()
,
gdzie:
![]()
-substancja rozpuszczona w pierwszym rozpuszczalniku ![]()
![]()
- substancji rozpuszczona w drugim rozpuszczalniku![]()
![]()
Obliczenie K:
K=![]()
,
gdzie: C1-Stężenie kwasu octowego w fazie wodnej
C2- Stężenie kwasu octowego w fazie chloroformowej
dla 1M roztworu kwasu octowego
K=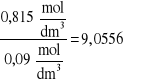
dla 0,75M roztworu kwasu octowego
K=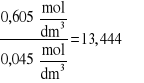
dla 0,5M roztworu kwasu octowego
K=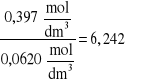
dla 0,25M roztworu kwasu octowego
K=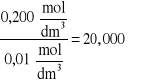
W tabeli 2 zestawiamy wyniki dotychczasowych obliczeń.
Za pomocą programu Excel wykreślamy wykres zależności ![]()
do f(![]()
). Wykres 1.
Znajdujemy wartość stałej dla układu z wykresu zależności (log c1) do f(log c2), jest to logarytmowana postać prawa Nernsta:
![]()
![]()
![]()
n1=![]()
n2=1
n3=1
n4=1
Analiza błędów:
Rachunek błędów:
![]()
![]()
![]()
dla 1M roztworu kwasu octowego
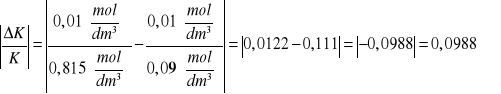
![]()
dla roztworu 0,75M kwasu octowego:
![]()
=0,205
![]()
20,50%
dla roztworu 0,5M kwasu octowego:
![]()
=0,0681
![]()
6,81%
dla roztworu 0,25M kwasu octowego:
![]()
=0,475
![]()
47,5%
Za pomocą programu Excel wykreślamy wykres zależności ![]()
do f(![]()
). Wykres 2. Do wykresu przeprowadzamy styczną za pomocą której otrzymujemy dane do równania prostej:
![]()
gdzie:
0,569
0,4449
Równanie ma następującą postać:
y = 0,569x + 0,4449
Obliczanie wartości Kgraf. na podstawie danych odczytanych z wykresu:
![]()
0,444
![]()
-0,444
![]()
![]()
Wnioski:
Dzięki doświadczeniu które wykonaliśmy możemy wyznaczyć współczynnik podziału kwasu octowego między dwie nie mieszające się fazy: wodę i chloroform. Błędy przy wyznaczaniu tej wartości mogą wynikać z mało dokładnego odczytu z biurety, zbyt krótkiego czasu pomiędzy rozwarstwianiem się faz.
Informacje pozyskane z instrukcji
Informacje pozyskane z instrukcji
8
![]()
- ilość moli zasady![]()
![]()
- ilość moli kwasu![]()
![]()
- stężenie zasady![]()
![]()
- stężenie kwasu![]()
![]()
- objętość zasady ![]()
![]()
- objętość kwasu ![]()
![]()
- średnia objętości zasady zużytej do miareczkowania ![]()
V- Objętość roztworów użyta do ekstrakcji[dm3]
Ci-Stężenia:
roztworu wyjściowego
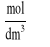
roztworu w fazie wodnej
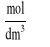
roztworu w fazie chloroformowej
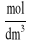
ni- liczba moli:
substancji w wyjściowym roztworze[mol]
substancji w fazie wodnej[mol]
substancji w fazie chloroformowej[mol]
Wyszukiwarka
Podobne podstrony:
tabele, chemia fizyczna, Nowy folder, zalaczniki
Lepkośc, chemia fizyczna, Nowy folder, zalaczniki
Napięcie, chemia fizyczna, Nowy folder, zalaczniki
jonity, chemia fizyczna, Nowy folder, zalaczniki
Bomba, chemia fizyczna, Nowy folder, zalaczniki
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
db, chemia fizyczna, Nowy folder, zalaczniki
tabela 1, chemia fizyczna, Nowy folder, zalaczniki
zadatermochemia, chemia fizyczna, Nowy folder, zalaczniki
cząstkowe objętości, chemia fizyczna, Nowy folder, zalaczniki
kalorymetr, chemia fizyczna, Nowy folder, zalaczniki
Ćw. 17, chemia fizyczna, Nowy folder
Ćw. 20, chemia fizyczna, Nowy folder
Ćw. 29, chemia fizyczna, Nowy folder
Ćw. 16, chemia fizyczna, Nowy folder
Ćw. 14, chemia fizyczna, Nowy folder
Ćw. 13, chemia fizyczna, Nowy folder
Ćw. 21, chemia fizyczna, Nowy folder
więcej podobnych podstron