Chemia, 2 rok studiów |
Julita Przeździecka Adrian Marzec |
Kielce 20.11.2009 |
Nr 17 |
Wyznaczenie równoważnika elektrochemicznego miedzi |
Ocena:
|
Cel ćwiczenia:
Wyznaczenie równoważnika elektrochemicznego miedzi oraz stałej Faraday'a
Etapy wykonania ćwiczenia:
1. Elektrody zanurzyć na chwilę w roztworze kwasu azotowego (1+1), Przepłukać wodą destylowaną i wysuszyć, następnie zważyć.
2. Uruchomić elektrolizer, umieścić elektrody.
3. Na podstawie umieścić zlewkę o pojemność 250 cm3 napełnioną roztworem siarczanu miedzi, włożyć mieszalnik i uruchomić mieszanie.
4. Po włączyć grzanie opuścić elektrody, aby zanurzone były w badanym roztworze do ¾ powierzchni.
5. Proces rozpocząć elektrolizy natężenie prądu: 0,6 A i prowadzić ją przez 15 minut.
6. Po zakończeniu elektrolizy, elektrodę opłukać wodą zakwaszoną H2SO4 ,przemyć wodą destylowaną i wysuszyć.
7. Tak przygotowaną elektrodę zważyć i obliczyć masę wydzielonej miedzi.
8. Pomiar wykonać dwukrotnie.
9. Elektrodę oczyścić z miedzi.
Zestawienie wyników:
|
Masa elektrody [g] |
Masa elektrody z wydzieloną miedzią [g] |
Masa miedzi [g] |
Temperatura początkowa [ºC] |
Temperatura końcowa [ºC] |
Napięcie [V] |
Natężenie [A] |
pomiar 1 |
14,6044g |
14,8484g |
0,2440g |
20,7ºC |
26,6ºC |
2,4V |
0,63A |
pomiar 2 |
14,6044g |
14,8269g |
0,2225g |
21,1ºC |
26,6ºC |
2,4V |
0,65A |
Tabela 1. Zestawienie wyników pomiarów doświadczenia.
Opracowanie wyników:
Obliczyć równoważnik elektrochemiczny miedzi
m = k*I*t![]()
gdzie:
m- masa wydzielonej miedzi ![]()
k- równoważnik elektrochemiczny miedzi![]()
I- natężenie prądu![]()
t- czasu jego przepływu![]()
Przekształcając powyższy wzór wyznaczamy równoważnik elektrochemiczny miedzi:
![]()
![]()
Średnia masa miedzi:
![]()
Średnie natężenie:
Iśr=0,64 A
![]()
Obliczyć stałą Faraday'a
![]()
gdzie:
F- Stała Faraday'a ![]()
R- Równoważnik chemiczny
![]()
gdzie:
M - masa atomowa[g/mol]
W - wartościowość
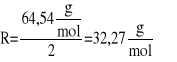
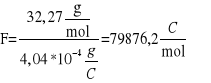
Błąd względny i bezwzględny
Flit=96485![]()
Błąd bezwzględny pomiaru:
![]()
,
gdzie:
Flit - wartość rzeczywista mierzonej wartości
F - wartość zmierzona
![]()
=16608,8
Błąd względny pomiaru:
![]()
,
gdzie:
![]()
błąd bezwzględny pomiaru
F- wartość rzeczywista mierzonej wielkości
![]()
![]()
Błąd bezwzględny pomiaru:
![]()
,
gdzie:
![]()
-wartość rzeczywista mierzonej wartości
k- wartość zmierzona
![]()
Błąd względny pomiaru:
![]()
,
gdzie:
![]()
-błąd bezwzględny pomiaru
![]()
- wartość rzeczywista mierzonej wielkości
![]()
Wnioski:
Przyczynami powstawania błędów, mniejszych lub większych, są wahające się natężenia prądu I, które podczas całego doświadczenia powinno być stałe. Niedokładność zważenia katody przed i po wykonaniu doświadczenia. Przypadkowe wytarcie osadzonej miedzi na katodzie podczas osuszania, a także niewystarczająco dokładne oczyszczenie katody przed przystąpieniem do ćwiczenia.
Informacje pozyskane z instrukcji
Informacje pozyskane z instrukcji
P.W. Atkins - Podstawy chemii fizycznej.
Szczeniowski S. Fizyka doświadczalna
2
Wyszukiwarka
Podobne podstrony:
tabele, chemia fizyczna, Nowy folder, zalaczniki
Lepkośc, chemia fizyczna, Nowy folder, zalaczniki
Napięcie, chemia fizyczna, Nowy folder, zalaczniki
jonity, chemia fizyczna, Nowy folder, zalaczniki
Bomba, chemia fizyczna, Nowy folder, zalaczniki
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
tabela 1, chemia fizyczna, Nowy folder, zalaczniki
zadatermochemia, chemia fizyczna, Nowy folder, zalaczniki
cząstkowe objętości, chemia fizyczna, Nowy folder, zalaczniki
Nernst(1), chemia fizyczna, Nowy folder, zalaczniki
kalorymetr, chemia fizyczna, Nowy folder, zalaczniki
Ćw. 17, chemia fizyczna, Nowy folder
Ćw. 20, chemia fizyczna, Nowy folder
Ćw. 29, chemia fizyczna, Nowy folder
Ćw. 16, chemia fizyczna, Nowy folder
Ćw. 14, chemia fizyczna, Nowy folder
Ćw. 13, chemia fizyczna, Nowy folder
Ćw. 21, chemia fizyczna, Nowy folder
więcej podobnych podstron