
CHEM:Iloczyn rozpuszczalności
1
CHEM:Iloczyn rozpuszczalności
Wstęp
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności jest wielkością charakteryzującą tworzenie się osadów trudno rozpuszczalnych soli MA,
znajdujących się w stanie równowagi z jonami M
+
i A
¯
, pochodzącymi z dysocjacji tej soli. Równowagi
odwracalnych reakcji tworzenia i dysocjacji trudno rozpuszczalnych związków przebiegających zgodnie z
równaniem
M
+
+ A¯ ↔ MA (↓)
można opisać za pomocą stałych równowagi
Stała
nazywana jest iloczynem rozpuszczalności. Przyjmując wartość [MA] jako stałą (osad stanowi fazę
stałą), wzór na iloczyn rozpuszczalności upraszcza się do postaci
Iloczyny rozpuszczalności są wielkościami stałymi dla danego rozpuszczalnika i określonej temperatury.
W przypadku reakcji typu
mM
n+
+ nA
m-
↔ M
m
A
n
(↓)
iloczyn rozpuszczalności trudno rozpuszczalnego związku wyraża się wzorem
Ze wzoru tego można korzystać charakteryzując roztwory trudno rozpuszczalnych substancji o niskiej sile jonowej,
ponieważ współczynniki aktywności jonów są bliskie wartości 1. Jeżeli jednak reakcja tworzenia trudno
rozpuszczalnego osadu zachodzi w roztworze o wysokiej sile jonowej (zawierającym obce jony o znacznym stężeniu
molowym), należy wówczas posługiwać się termodynamicznym (aktywnościowym) iloczynem rozpuszczalności
Rozpuszczalność substancji trudno rozpuszczalnych może być określona nie tylko za pomocą iloczynu
rozpuszczalności (
), ale również za pomocą rozpuszczalności (R), którą podaje się zazwyczaj w gramach na
dm
3
.
Z przedstawionych powyżej rozważań na temat iloczynu rozpuszczalności wynikają ważne wnioski:
• strącanie osadu soli trudno rozpuszczalnych zaczyna się po przekroczeniu takich stężeń jonów, których iloczyn
ma wartość
tej soli;
• jeżeli w roztworze obecne są różne jony tworzące trudno rozpuszczalne osady z tym samym czynnikiem
strącającym, to w pierwszej kolejności strąca się sól, której iloczyn rozpuszczalności jest najmniejszy, a następne
sole strącają się w kolejności wzrastających wartości
;
• zmiana stężenia jednego z jonów pozostającym w równowadze z osadem powoduje odpowiednią zmianę stężenia
drugiego jonu, aby ich iloczyn pozostał stały;

CHEM:Iloczyn rozpuszczalności
2
• wzrost siły jonowej wynikający z obecności elektrolitów nie mających jonów wspólnych z osadem powoduje
wzrost stężenia jonów M
n+
i A
m-
, czyli wzrost rozpuszczalności.
Reakcje strącania osadów dzieli się na 3 typy:
• tworzenie trudno rozpuszczalnych soli
Ag
+
+ Cl¯ → AgCl↓,
• tworzenie trudno rozpuszczalnych wodorotlenków
Cu
2+
+ 2OH¯ → Cu(OH)
2
↓,
• tworzenie trudno rozpuszczalnych kwasów
SiO
32-
+ 2H
+
→ H
2
SiO
3
↓.
Osady trudno rozpuszczalne w analizie
Strącanie osadów trudno rozpuszczalnych związków jest podstawą analitycznych metod rozdzielania, wykrywania i
oznaczania pierwiastków. Osady mające znaczenie w analizie chemicznej można podzielić na 2 grupy: osady
krystaliczne i osady koloidalne.
Osady krystaliczne charakteryzują się uporządkowana budową krystaliczną. Postać drobnokrystaliczna lub
grubokrystaliczna osadu zależy od sposobu jego strącania. Po przekroczeniu iloczynu rozpuszczalności tworzą się
najpierw tzw. zarodki krystaliczne, które wzrastają do rozmiarów właściwych kryształów. Jeżeli warunki strącania
umożliwiają powstaniecie niewielkiej liczby zarodków, to otrzymuje się osad gruboziarnisty. Powstawanie takich
osadów zapewnia mały nadmiar czynników strącających i ich powolne dodawanie, mieszanie roztworu, wysoka
temperatura. Osady koloidalne powstają w wyniku łączenia się cząsteczek trudno rozpuszczalnej substancji w
aglomeraty posiadające jednoimienne ładunki elektryczne, które odpychając się wzajemnie tworzą zol. Pod
wpływem elektrolitu następuje koagulacja zolu w żel, czyli strącanie osadu koloidalnego. Przemywanie osadu
koloidalnego wodą powoduje proces odwrotny, czyli przechodzenie żelu w zol (peptyzacja).
Osady koloidalne maja dużą powierzchnię i wykazują zdolność do adsorbowania innych jonów obecnych w
roztworze, co prowadzi do znacznego zanieczyszczenia osadów. Dokładne ich oczyszczenie wymaga procesu
podwójnego strącania.
Osady koloidalne dzieli się na hydrofilowe (wykazujące duże powinowactwo do wody) oraz hydrofobowe
(niechętnie przyłączające cząsteczki wody). Przykładem koloidu hydrofilowego jest uwodniony kwas krzemowy,
którego koagulacja wymaga wysokiego stężenia elektrolitu. Przykładem koloidu hydrofobowego jest As2S3, który
ulega szybkiej koagulacji po dodaniu niewielkiej ilości elektrolitu.
Część doświadczalna
Cel ćwiczenia
• Strącanie trudno rozpuszczalnych osadów w roztworach wodnych zawierających jony metali.
• Analiza jakościowa jonów metali.
• Identyfikacja jonów metali w mieszaninach.
Zagadnienia do przygotowania
• Układ dyspersyjny.
• Roztwór właściwy.
• Roztwór koloidalny.
• Osad krystaliczny i koloidalny.

CHEM:Iloczyn rozpuszczalności
3
• Rozpuszczalność, iloczyn rozpuszczalności (stężeniowy i aktywnościowy).
Odczynniki
• Sole: CaCl
2
, SnCl
2
, MgCl
2
, FeCl
3
, AlCl
3
, MnSO
4
, NiSO
4
, ZnSO
4
, CuSO
4
, FeSO
4
(substancje stałe).
• Pb(NO
3
)
2
(roztwór wodny) (związek toksyczny!).
• Czynniki strącające osady: KOH, H
3
PO
4
, KJ, KSCN, Na
2
C
2
O
4
, K
4
[Fe(CN)
6
] (roztwory wodne).
Wykonanie ćwiczenia
• Przygotować 100 cm3 roztworu wodnego każdej soli o stężeniu 0,01 M
• Umieścić w statywie probówki (co najmniej 8 sztuk)
• Do każdej probówki wlać 3 ml roztworu wybranej soli (w każdej probówce inny kation)
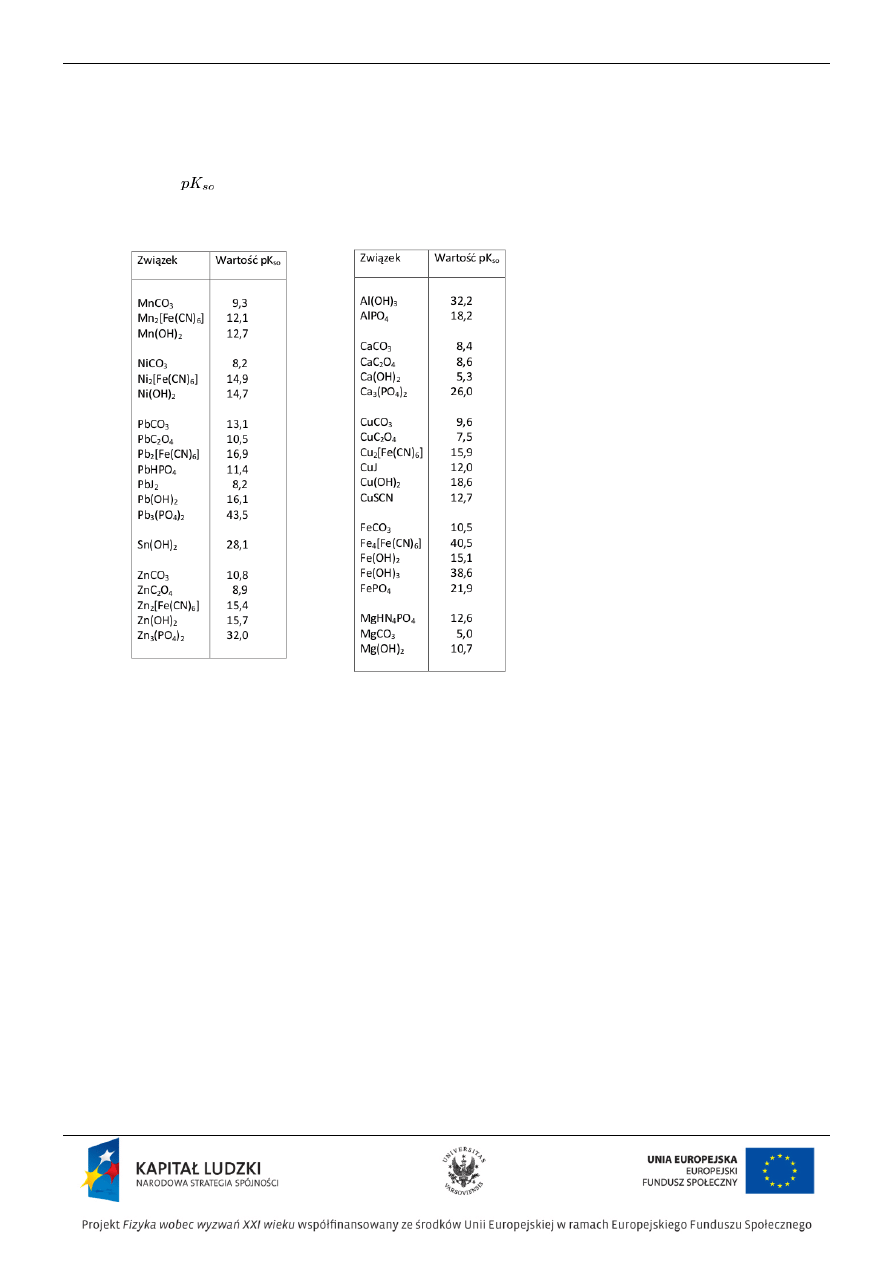
• Na podstawie wartości Kso odczytanej z tablic wybrać dla każdego kationu przynajmniej jeden czynnik
strącający trudno rozpuszczalny osad
• Dla każdego kationu przeprowadzić przynajmniej jedną reakcję strącania osadu wkraplając czynnik strącający do
probówki zawierającej roztwór odpowiedniego kationu
• Zapisać zaobserwowany efekt (barwę, postać i trwałość osadu)
• Napisać reakcje tworzenia trudno rozpuszczalnych osadów dla zbadanych kationów
• Dla dwóch wybranych reakcji obliczyć minimalne stężenie czynnika strącającego, przy którym zacznie się strącać
osad
• Wykorzystać reakcje strącania do identyfikacji kationów w mieszaninie przygotowanej przez osobę prowadzącą
• Ze względu na toksyczne właściwości związków ołowiu, reakcje z Pb(NO3)2 będą przeprowadzone tylko w
formie pokazów, przez osoby prowadzące ćwiczenia.
CHEM:Iloczyn rozpuszczalności
4
Literatura
J. Minczewski, Z. Marczenko, „Chemia analityczna”, Wydawnictwo Naukowe PW
Wartości
dla wybranych trudno rozpuszczalnych związków
(podane wartości są ujemnymi logarytmami iloczynów rozpuszczalności)

Źródła i autorzy artykułu
5
Źródła i autorzy artykułu
CHEM:Iloczyn rozpuszczalności Źródło: https://brain.fuw.edu.pl/edu-wiki/index.php5?oldid=13756 Autorzy: Asia
Źródła, licencje i autorzy grafik
Plik:wartosci pkso.png Źródło: https://brain.fuw.edu.pl/edu-wiki/index.php5?title=Plik:Wartosci_pkso.png Licencja: nieznany Autorzy: -
Licencja
Attribution-Share Alike 3.0 PL
http:/
Document Outline
Wyszukiwarka
Podobne podstrony:
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Iloczyn rozpuszczalnoÂci, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
iloczyn rozpuszczalnosci id 210 Nieznany
Hydroliza soli iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci (Kso) Nieznany
Iloczyn rozpuszczalności(1), Chemia, Chemia nieorganiczna
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
iloczyn rozpuszczalnosci, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
W10s-rownowagi heterogeniczne-Iloczyn rozpuszczalnosci, chemia, szkolka
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron