TEST: Reakcje w roztworach wodnych elektrolitów (wersja I)
1. Uzupełnij następujące zdania:
a) ......................... jest to rozpad na jony cząsteczek .................... pod wpływem wody.
b) Kwasy dysocjują, odszczepiając .................... wodoru i aniony ................................. .
c) Kwasy wieloprotonowe dysocjują ..................... .
d) .................. dysocjują, odszczepiając kationy ................ i ................ wodorotlenkowe.
e) Sole dysocjują na ............................. metalu i .............................. reszt kwasowych.
2. Korzystając z tabeli rozpuszczalności soli i wodorotlenków, wybierz dwie sole, z których roztworów można wytrącić siarczek miedzi(II). Zapisz równanie tej reakcji w sposób: cząsteczkowy, jonowy i jonowy skrócony.
3. Co to jest hydroliza soli?
4. Oblicz stopień dysocjacji kwasu azotowego(III) o stężeniu 0,1 i o pH = 4.
5. Które z wymienionych związków chemicznych ulegają hydrolizie?
Napisz odpowiednie równania reakcji hydrolizy.
NaOH, NaCl, K2CO3, H2O2, CuCl2, H2SO4.
6. Uzupełnij następujące zdania:
a) Stopień dysocjacji jest to stosunek .......................... cząsteczek, które .................... procesowi dysocjacji,
do ................... moli .................... wprowadzonych do roztworu.
b) Stopień dysocjacji zależy od ............................ i .......................... roztworu.
c) Elektrolity .................... są praktycznie zdysocjowane całkowicie, podczas gdy elektrolity .................... wykazują .................... stopień dysocjacji.
d) Do elektrolitów .................... zaliczają się np. HNO3, HCl, NaOH, Na2SO4, zaś do elektrolitów .................... zaliczają się np. H2CO3, H2S, NH3 · H2O.
7. Podaj wzory substancji, które w roztworze wodnym dysocjują na jony:
a) K+ i PO43-
b) H+, HCO3- , CO32-
c) Na+ i OH-
d) Cu2+ i Cl-
8. Z podanych substancji wybierz te, które rozpuszczone w wodzie ulegną dysocjacji jonowej.
Zapisz dla nich odpowiednie równania reakcji dysocjacji.
CuO, Ca(OH)2, NO, MgCl2, Fe2O3, HNO3
9. Uzupełnij następujące równania reakcji dysocjacji jonowej soli:
a) CuCl2 ..... + .....
b) .......... Na+ + HCO3-
c) K2SO4 ..... + .....
d) .......... Al3+ + 3 NO3-
10. Wodny roztwór słabego kwasu jednoprotonowego zawiera 0,2 mola jonów H+ i 2 mole niezdysocjowanych cząsteczek. Oblicz stopień dysocjacji tego kwasu.
11. pH pewnego roztworu wynosi 2. Z podanych substancji podkreśl te, które mogłyby się znajdować
w tym roztworze.
KCl, HCl, NaOH, Ba(OH)2, H2SO4, Na2SO4
12. Pojęciom oznaczonym liczbami przyporządkuj odpowiednie zapisy oznaczone literami.
1. hydroliza a) H+ + OH- H2O
2. zobojętnianie b) CO
3. strącanie osadów c) Fe2+ + 2 H2O Fe(OH)2 + 2 H+
4. odczyn kwasowy roztworu d) [H+] = [OH-]
5. pH roztworu e) CuSO4 Cu2+ + SO42-
6. stopień dysocjacji f) [H+] < [OH-]
7. dysocjacja jonowa g) [H+] > [OH-]
8. odczyn zasadowy roztworu h) Pb2+ + S2- PbS
9. odczyn obojętny roztworu i) α = • 100%
j) na przykład 4
13. Uczniowie określali pH roztworów następujących substancji: HCl, KOH, Na2SO4, CuCl2, K2CO3. Wyniki umieścili w tabeli. Który z uczniów poprawnie wykonał zadanie?
Uczeń |
HCl |
KOH |
Na2SO4 |
CuCl2 |
K2CO3 |
I |
pH = 5 |
pH = 6 |
pH = 7 |
pH = 10 |
pH = 6 |
II |
pH = 10 |
pH = 6 |
pH = 8 |
pH = 3 |
pH = 12 |
III |
pH = 2 |
pH = 8 |
pH = 7 |
pH = 4 |
pH = 9 |
IV |
pH = 1 |
pH = 10 |
pH = 10 |
pH = 5 |
pH = 4 |
14. Rysunek przedstawia schematy doświadczeń.
HCl HCl HCl HCl
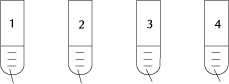
K2S KOH KCl K2CO3
W którym przypadku zaszła reakcja zobojętniania? Napisz równanie tej reakcji:
cząsteczkowo, jonowo i jonowo w sposób skrócony.
15. Do probówek z wodą wprowadzono substancje:
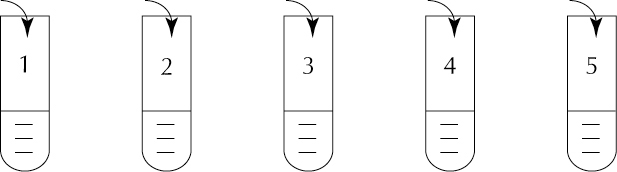
BaCl2 Pb(NO3)2 NO NH3 SO2
W której poziomej kolumnie w tabeli prawidłowo przedstawiono stężenie jonów?
|
[H+] > [OH-] |
[H+] = [OH-] |
[H+] < [OH-] |
I |
1, 2 |
3, 5 |
4 |
II |
3, 5 |
1 |
2, 4 |
III |
5 |
1, 2 |
3, 4 |
IV |
2, 5 |
1, 3 |
4 |
Uwaga! Cyfry arabskie przedstawiają numery probówek.
16. W czterech probówkach znajdują się wodne roztwory następujących soli: AgNO3, Fe(NO3)2, Zn(NO3)2, Al(NO3)3. Korzystając z tabeli rozpuszczalności soli i wodorotlenków, wybierz jeden wspólny odczynnik, który wytrąci osady we wszystkich probówkach. Zapisz równania odpowiednich reakcji w formie jonowej skróconej.
dm3
mol
H2O
H2O
H2O
H2O
H2O
nz
nw
Wyszukiwarka
Podobne podstrony:
4908
4908
4908
4908
praca-licencjacka-b7-4908, Dokumenty(8)
4908
4908
4908
4908
4908
więcej podobnych podstron