Nr. ćwiczenia 6 |
Temat: Otrzymywanie i własności koloidów |
grupa 34 |
Data wyk.
19-10-1999 |
Katarzyna Augustyn Agnieszka Przytocka |
zespół 6 |
WSTĘP TEORETYCZNY.
Koloidy to mieszaniny niejednorodne pod względem fizycznym i chemicznym. Charakteryzują się określonym stopniem rozdrobnienia faz ( jedna z faz jest rozproszona w drugiej ). Faza rozproszona i faza rozpraszająca mogą występować w dowolnym stanie skupienia, ale pojęcie układy koloidalnego dotyczy fazy rozproszonej o wymiarach 1-300 nm. Koloidy otrzymujemy metodami dyspersyjnymi tj. polegającymi na zmniejszeniu rozmiarów cząstek o charakterze grubodyspersyjnym do rozmiarów koloidalnych; lub metodami kondensacyjnymi np. wydzieleniu trudno rozpuszczalnych substancji z roztworu silnie rozcieńczonego na drodze reakcji chemicznej.
Roztwory koloidalne są przeźroczyste i klarowne, charakteryzują się własnością rozpraszania światła ( efekt Tyndalla ). Charakterystyczne procesy, którym ulegają koloidy to:
koagulacja - tendencja do łączenia się w większe agregaty (wytrącania się z roztworów), zwykle nie zachodzi samorzutnie tylko w momencie w którym zostanie osiągnięte całkowite zobojętnienie elektryczne czastek (punkt izoelektryczny);
peptyzacja - zjawisko przechodzenia skoagulowanego osadu z powrotem w stan roztworu koloidalnego;
elektrofereza - zjawisko wędrówki cząstek koloidalnych pod wpływem pola elektrycznego.
Wśród koloidów wyróżniamy:
liofobowe - nie ulegające solwatacji (nietrwałe)
liofilowe - w przypadku których solwatacja działa stabilizująco.
2. OPIS ĆWICZENIA
Celem ćwiczenia jest otrzymanie zolu uwodnionego tlenku żelazowego poprzez hydrolizę FeCl3 a następnie jego koagulację pod wpływem elektrolitu. Reakcja przeprowadzana jest w temp. 100° poprzez wkroplenie roztworu 0,25n FeCl3 do wrzącej wody.
Podczas hydrolizy powstają stopniowo sole zasadowe o coraz niższej rzędowości, aż do powstania Fe(OH)3, praktycznie nierozpuszczalnego w H2O
FeCl3 + H2O => Fe(OH)Cl2 + HCl
Fe(OH)Cl2 + H2O => Fe(OH)2Cl + HCl
Fe(OH)2Cl + H2O => Fe(OH)3 + HCl
Strącający się Fe(OH)3, wydziela sie z roztworu w postaci submikroskopowych kryształów Fe2O3 * nH2O.
Jednocześnie z tym procesem zachodzi adsorbcja jonów Fe3+ na powierzchni kryształów (z wbudowaniem ich w sieć krystaliczną), oraz reakcje, qw wyniku których do roztworu uwolnione zostają jony Cl- (adsorbcja Fe3+ na powierzchni kryształów soli zasadowych, reakcje powierzchniowe Fe(OH)3 z solami żelaza). Wszystkie te procesy powodują, że cząstki hydratu Fe(OH)3 uzyskują na tyle duży ładunek dodatni, aby pod wpływem wprowadzonego elektrolitu otzrzymać zol.
3. WYKONANIE ĆWICZENIA.
3.1. Przygotowanie 0,25n roztworu FeCl3
3.2. Przygotawanie roztworów elektrolitów:
0,001 n K4(Fe(CN)6)
0,001 n K3(Fe(CN)6)
0,02 n Na2SO4
3.3. Otrzymanie uwodnionego zolu Fe2O3 poprzez powolne wkroplenie 62,5 ml 0,25 n FeCl3 do 250 ml (doprowadzonej do wrzenia w płaszczu grzejnym) wody.
3.4. Miareczkowanie próbki zolu (10 ml) roztworem elektrolitu do momentu zaobserwowania zmętnienia (zajścia koagulacji).
OBLICZENIA.
4.1.Przeliczenie stężeń roztworów
|
FeCl3 |
K4(Fe(CN)6) |
K3(Fe(CN)6) |
Na2SO4 |
zadana objętość [ml] |
1000 |
250 |
250 |
500 |
zadane stężenie n |
0,25 |
0,001 |
0,001 |
0,02 |
masa molowa [g/mol] |
162,5 |
368 |
329 |
322,21 |
gramorównoważnik Eq [val] |
54,17 |
92 |
109,6 |
161,1 |
stężenie Eq/l [g] |
13,5 |
0,092 |
0,11 |
3,2 |
stężenie molowe [mol/l] |
0,083 |
2,5 10- 4 |
3,34 10- 4 |
9,93 10- 3 |
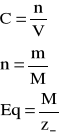
Użyte wzory:
gdzie:
C- stęzenie molowe [mol/l]
n- liczba moli
V- objętość [l]
m- masa [g]
M- masa molowa [g/mol]
Eq- gramorównoważnik [val ]
z-- ładunek anionu
Obliczenie stężenia elektrolitu powodującego koagulację (val/l).
|
Eq [val] |
C [val/l] |
K4(Fe(CN)6) |
92 |
0,00893 |
K3(Fe(CN)6) |
109,6 |
0,0104 |
Na2SO4 |
161,16 |
0,0156 |
![]()
Użyty wzór:
gdzie:
C- stęzenie molowe [mol/l]
V- objętość [l]
Eq- gramorównoważnik [val ]
4.3. Obliczenie stęże molowych jonów elektrolitów
K4(Fe(CN)6)
C = 2,5 10-4 [mol/l]
[K+] = 4*C = 0,1 10-4 [mol/l]
[Fe(CN)64 -] = 2,5 10-4 [mol/l]
K3(Fe(CN)6)
C = 3,34 10-4 [mol/l]
[K+] = 3*C = 0,1 10-4 [mol/l]
[Fe(CN)63 -] = 3,34 10-4 [mol/l]
Na2SO4
C = 9,93 10-3 [mol/l]
[Na+] = 2*C = 0,2 10-3 [mol/l]
[SO42-] = 9,93 10-3 [mol/l]
Obliczenie siły jonowej mieszaniny (elektrolit + FeCl3)
|
J |
J 0,5 |
K4(Fe(CN)6)+FeCl3 |
0,5 |
0,71 |
K3(Fe(CN)6) +FeCl3 |
0,5 |
0,71 |
Na2SO4+FeCl3 |
0,53 |
0,73 |
![]()
Użyty wzór:
gdzie:
J- siła jonowa
Ci- stężenie molowe jonu
zi - ładunek jonu
Obliczenie współczynników aktywności zgodnie z prawem Debye'a - Hückla.
|
log f |
f |
K4(Fe(CN)6)+FeCl3 |
-1,425 |
0,037 |
K3(Fe(CN)6) +FeCl3 |
-1,07 |
0,085 |
Na2SO4+FeCl3 |
-0,74 |
0,18 |
![]()
Użyty wzór:
gdzie:
f - współczynnik aktywności
z+- ładunek kationu
z- - ładunek anionu
J - siła jonowa
Obliczenie względnych wartości koagulacyjnych przeciwjonów przyjmując wartość koagulacyjną Fe(CN)64 - za równą jednostce.
|
Stężenie anionu [mol/l] |
Wzgl. wartość koagulacyjna |
K4(Fe(CN)6) |
2,5 10- 4 |
1 |
K3(Fe(CN)6) |
3,34 10- 4 |
1,34 |
Na2SO4 |
9,93 10-3 |
39,7 |
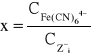
Użyty wzór:
gdzie
x- względna wartość koagulacyjna
![]()
Cz- wartość koagulacyjna poszczególnych przeciwjonów
ZESTAWIENIE WYNIKÓW.
|
Zużyta objętość (ml)
|
Obj. mieszaniny w kobce w momencie koagulacji [ml] |
Stęż. elektrolitu powodujące koagulację [val/l] |
|
|
I |
II |
|
|
K4(Fe(CN)6) 0,001n |
0,3 |
0,3 |
10,3 |
0,00893 |
K3(Fe(CN)6) 0,001n |
0,5 |
0,5 |
10,5 |
0,0104 |
Na2SO4 0,02n |
0,3 |
0,3 |
10,3 |
0,0156 |
|
[z+] mol/l |
[z -] mol/l |
J |
J0,5 |
log f |
f |
x |
K4(Fe(CN)6) 0,001n |
10- 3 |
2,5 10- 4 |
0,5 |
0,71 |
-1,425 |
0,037 |
1 |
K3(Fe(CN)6) 0,001n |
10- 3 |
3,34 10- 4 |
0,5 |
0,71 |
-1,07 |
0,085 |
1,34 |
Na2SO4 0,02n |
2 10- 2 |
9,93 10- 3 |
0,53 |
0,73 |
-0,74 |
0,18 |
39,7 |
PODSUMOWANIE
6.1. Ze wzrostem mocy elektrolitu zwiększa się szybkość procesu koagulacji (najszybciej w przypadku Fe(CN)64-, najwolniej dla SO42-).
6.2. Wielkość względnej wartości koagulacyjnej określa ilość dodanego elektrolitu w odniesieniu do elektrolitu wzorcowego (Fe(CN)64-) i mówi o ile więcej trzeba go zużyć, aby wywołać ten sam efekt koagulacyjny.
6.3.Współczynnik aktywności dla roztworów bardzo rozcieńczonych jest mniejszy od 1 i odwrotnie proporcjonalny do mocy elektrolitu a wprostproporcjonalny do stężenia elektrolitu.
3
1
![]()
![]()
![]()
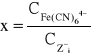
![]()
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron