Opracowanie wyników
obliczenie Δm
Nr. kolby |
Masa pustej kolby [g] |
Masa kolby z roztworem [g] |
Δm [g] |
1 |
133,60 |
183,23 |
49,63 |
2 |
128,95 |
178,43 |
49,48 |
3 |
108,36 |
133,06 |
24,70 |
4 |
128,00 |
152,69 |
24,69 |
obliczanie gęstości roztworów ze wzoru
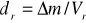
, gdzie Δm - różnica mas kolby z nasyconym roztworem kwasu benzoesowego i kolby pustej, Vr - objętość kwasu przed miareczkowaniem np.
d1=![]()
![]()
Analogiczne obliczenia stosujemy dla pozostałych roztworów:
Nr. kolby |
Δm [g] |
Vr [cm3] |
dr [g/cm3] |
1 |
49,63 |
50 |
0,9326 |
2 |
49,48 |
50 |
0,9896 |
3 |
24,70 |
25 |
0,9880 |
4 |
24,69 |
25 |
0,9876 |
obliczanie stężenia molowego kwasu benzoesowego z zależności:
![]()
gdzie Vkwasu - objętość roztworu przed miareczkowaniem, ckwasu - stężenie molowe kwasu benzoesowego w roztworze, VNaOH - objętość mianowanego roztworu NaOH użyta podczas miareczkowania, cNaOH - stężenie mianowanego roztworu NaOH (0,1003 mol/dm3)
Nr. Kolby |
VNaOH [cm3] |
cNaOH [mol/dm3] |
Vkwasu [cm3] |
ckwasu [mol/dm3] |
1 |
16,9 |
0,1003 |
50 |
0,0339 |
2 |
17,0 |
0,1003 |
50 |
0,0341 |
3 |
11,6 |
0,1003 |
25 |
0,0465 |
4 |
11,1 |
0,1003 |
25 |
0,0445 |
Kolba 1
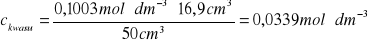
Kolba 2
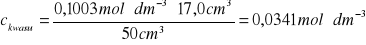
Kolba 3
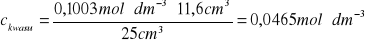
Kolba 4
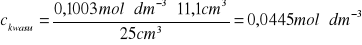
d) obliczenie rozpuszczalności z zależności:
K=![]()
, gdzie: cr - stężenie molowe wyznaczone metodą miareczkowania alkacymetrycznego roztworu nasyconego w danej temperaturze [mol/dm3], Ms - masa molowa substancji (dla kwasu benzoesowego = 122,12 g/mol), dr - gęstość roztworu nasyconego danej substancji [g/dm3].
Nr. Kolby |
cr [mol/dm3] |
dr [g/dm3] |
Rs [g/100 cm3 H2O] |
1 |
0,0339 |
932,6 |
0,4454 |
2 |
0,0341 |
989,6 |
0,4222 |
3 |
0,0465 |
988,0 |
0,5663 |
4 |
0,0445 |
987,6 |
0,5528 |
Kolba numer 1-
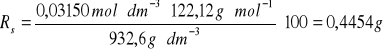
/100 g H2OKolba numer 2-
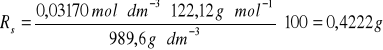
/100 g H2OKolba numer 3-
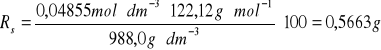
/100 g H2OKolba numer 4-
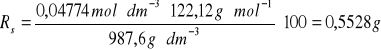
/100 g H2O
e) wyznaczenie entalpii procesu rozpuszczania,
T1 K1 = ![]()
![]()
![]()
K![]()
=![]()
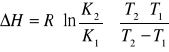
, gdzie: K2 i K1 - rozpuszczalność substancji w temperaturach T2 i T1, R - stała gazowa [![]()
], T1 - 300,15K, T2 - 313,15K. Podstawiając dane do wzoru otrzymujemy:
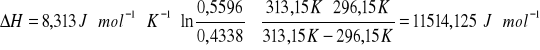
Wartość średnia ΔH wynosi 11514,125 J/mol=11,514 kJ/mol
Wyznaczanie entalpii rozpuszczania biorąc pod uwagę kąt nachylenia prostej:
Równanie prostej opisującej wykres dane jest wzorem: y= -1601,42x +5,77
a= - 1601,42 K
Następnie sporządzamy wykres zależności stałej równowagi. Wykorzystując wartość tg α odczytaną z funkcji wykresu, można obliczyć entalpię rozpuszczania ze wzoru:
![]()
ΔH=24,6032 kJ/mol
5.Wnioski
Entalpia rozpuszczania kwasu benzoesowego jest reakcją endotermiczną, czego dowodzi wykres. Rozpuszczalność kwasu rośnie wraz ze wzrostem temperatury. Porównując metodę algebraiczną z teoretyczną , uzyskujemy zbliżone wyniki, co dowodzi słuszności zastosowanej metody. Wartości na wykresie dla obydwu wartości lnK2 nieco odbiegają od siebie w porównaniu do lnK1, czego przyczyna mogły być błędy pomiarowe- szczególnie dużą różnicą w stężeniach molowych obydwu roztworów, gdyż roztwór ten miał wyższą temperaturę. Mogło to spowodować błędy podczas miareczkowania , na co wpływ miało ochłodzenie się roztworu i wytrącenie części kwasu.
Wyszukiwarka
Podobne podstrony:
Obliczenia91, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
fiz 62 poprawione, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawo
fiz 66, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
Przedmiotem ergonomii ost, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, BHP
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
fiz 13, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
7, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
podstawy test, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, PODSTAWY ŻYWIENI
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
B Egzamin testowy z przedmiotu, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok,
C Egzamin testowy z przedmiotu, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok,
sprawozdanienr41, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
więcej podobnych podstron