Mangan |
|
|||||
|
|
|||||
|
|
|
|
|
||
+II |
+III |
+IV |
+VI |
+VII |
||
cechy metaliczne |
cechy metaliczne |
cechy amfoteryczne |
cechy kwasotwórcze |
cechy kwasotwórcze |
||
sole manganu trwałe w rozt. wodnych - MnSO4 |
sole manganu trwałe w kryształach |
MnO2 - braunsztyn |
K2MnO4 - manganian potasu |
KMnO4 nadmanganian potasu |
||
bezbarwny |
bezbarwny |
brunatny |
zielony |
fioletowy |
||
|
|
|||||
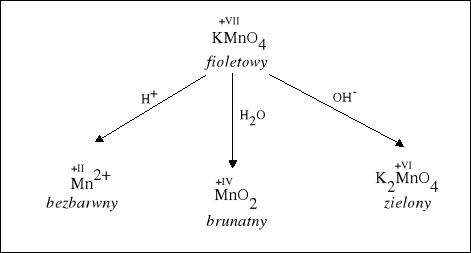
Wpływ środowiska reakcji na redukcję jonów MnO4-. |
||||||
|
||||||
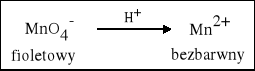
1. W środowisku kwasowym Mangan zmienia stopień utlenienia z +VII na +II. |
||||||
|
||||||
2 KMnO4 + 5 K2SO3 + 3 H2SO4 = 2 MnSO4 + 6 K2SO4 + 3 H2O |
||||||
2 KMnO4 + 5 MgI2 + 8 H2SO4 = 2 MnSO4 + K2SO4 + 5 MgSO4 + 5 I2 + 8 H2O |
||||||
2 KMnO4 + 5 Na2S + 8 H2SO4 = 2 MnSO4 + 5 Na2SO4 + K2SO4 + 5 S + 8 H2O |
||||||
2 KMnO4 + 10 NaCl + 8 H2SO4 = 2 MnSO4 + 5 Na2SO4 + K2SO4 + 5 Cl2 + 8 H2O |
||||||
|
||||||
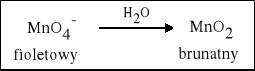
2. W środowisku obojętnym Mangan zmienia stopień utlenienia z +VII na +IV. |
||||||
|
||||||
2 KMnO4 + 3 K2SO3 + H2O = 2 MnO2 + 3 K2SO4 + 2 KOH |
||||||
2 KMnO4 + 3 SO2 + 2 H2O = 2 MnO2 + K2SO4 + 2 H2SO4 |
||||||
|
||||||
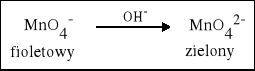
3. W środowisku zasadowym Mangan zmienia stopień utlenienia z +VII na +VI. |
||||||
|
||||||
2 KMnO4 + K2SO3 + 2 KOH = 2 K2MnO4 + K2SO4 + H2O |
||||||
2 KMnO4 + MnO2 + 4 NaOH = K2MnO4 + 2 Na2MnO4 + 2 H2O |
||||||
|
||||||
Inne reakcje: |
||||||
MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2 |
||||||
2 MnO2 + 4 NaOH + O2 = 2 Na2MnO4 + 2 H2O |
||||||
3 MnO2 + KClO3 + 6 KOH = 3 K2MnO4 + KCl + 3 H2O |
||||||
3 K2MnO4 + 2 H2SO4 = MnO2 + 2 KMnO4 + 2 K2SO4 + 2 H2O |
||||||
3 K2MnO4 + 2 H2O = MnO2 + 2 KMnO4 + 4 KOH |
||||||
K2MnO4 + 8 HCl = MnCl2 + 2 KCl + 2 Cl2 + 4 H2O |
||||||
MnSO4 + 2 Na2CO3 + 2 KNO3 = Na2MnO4 + 2 KNO2 + Na2SO4 + 2 CO2 |
||||||
2 KMnO4 = K2MnO4 + MnO2 + O2 |
||||||
Chrom |
|
|||
|
|
|||
|
|
|||
+II |
+III |
+VI |
||
cechy zasadowe |
cechy amfoteryczne |
cechy kwasotwórcze |
||
CrO (czarny) CrSO4 |
Cr2O3 (zielony) CrCl3; Cr(OH)3 |
CrO3 (ciemnoczerwony) K2CrO4 - chromian potasu (żółty) K2Cr2O7 - dichromian potasu (pomarańczowy) |
||
|
|
|||
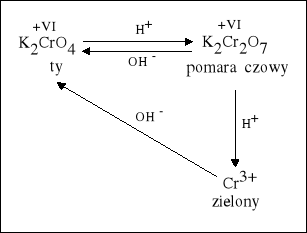
Wpływ środowiska |
||||
|
||||
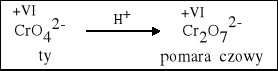
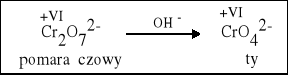
1. W środowisku kwasowym chromian przechodzi w dwuchromian. |
||||
|
||||
2 K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O |
||||
|
||||
2. W środowisku zasadowym dwuchromian przechodzi w chromian. |
||||
|
||||
K2Cr2O7 + 2 KOH = 2 K2CrO4 + H2O |
||||
|
||||
Inne reakcje: |
||||
|
||||
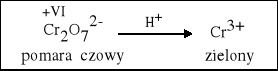
W środowisku kwasowym dwuchromian (VI) przechodzi w sól chromu (III). |
||||
|
||||
K2Cr2O7 + 3 K2SO3 + 4 H2SO4 = Cr2(SO4)3 + 4 K2SO4 + 4 H2O |
||||
K2Cr2O7 + 14 HCl = 2 CrCl3 + 2 KCl + 3 Cl2 + 7 H2O |
||||
K2Cr2O7 + 3 SnCl2 + 14 HCl = 2 CrCl3 + 3 SnCl4 + 2 KCl + 7 H2O |
||||
K2Cr2O7 + 3 H2S + 4 H2SO4 = Cr2(SO4)3 + K2SO4 + 3 S + 7 H2O |
||||
2 CrO3 + 12 HCl = 2 CrCl3 + 3 Cl2 + 6 H2O |
||||
|
||||
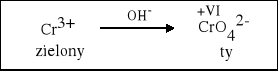
W środowisku zasadowym sól chromu (III) przechodzi w chromian (VI) |
||||
|
||||
Cr2O3 + 3 KNO3 + 4 KOH = 2 K2CrO4 + 3 KNO2 + 2 H2O |
||||
2 CrCl3 + 3 H2O2 + 10 NaOH = 2 Na2CrO4 + 6 NaCl + 8 H2O |
||||
2 Cr3+ + 3 Cl2 + 16 OH- = 2 CrO42- + 6 Cl- + 8 H2O |
||||
Wyszukiwarka
Podobne podstrony:
zelazo chrom mangan, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
mangan i chrom poprawione, chemia nieorganiczna, zalaczniki2
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
więcej podobnych podstron