27
Laboratoria Chemii Fizycznej
ĆWICZENIE NR 54
TEMAT: Skalowanie elektrody szklanej
Piotr Tylak
Data: 2.06.2009r.
Godziny zajęć: 12:15 - 16:15
Cel ćwiczenia: Celem ćwiczenia jest wyznaczenie zakresu aktywności jonów wodorowych w roztworze (zakresu pH roztworu), dla którego potencjał elektrody szklanej zmienia się prostoliniowo.
Wstęp teoretyczny:
Do wyznaczania pH mogą służyć półogniwa:
-wodore
-tlenkowe (antymonowe,irydowe)
-chinhydronowe
W praktyce najczęściej stosowana jest elektroda szklana należąca do grupy półogniw specjalnych (membranowych)
Siła elektromotoryczna SEM ogniwa pozwala oznaczyć pH roztworu. Zasada elektronicznego pomiaru wartości pH jest następująca. Zanurzenie elektrody pomiarowej do zakwaszonego roztworu wodnego powoduje powstanie siły elektromotorycznej (SEM) między tą elektrodą i roztworem, a wartość SEM jest bezpośrednią miarą koncentracji jonów wodoru.
Elektroda pomiarowa składa się z rurki szklanej, zwanej elektrodą szklaną (jej potencjał jest funkcją liniową pH), i z zawartego w niej roztworu standardowego. Do prawidłowego pomiaru SEM potrzebny jest jeszcze potencjał odniesienia. Do tego służy następna zanurzona elektroda. Ze względu na materiał, jakiego się używa na tę elektrodę, jest ona nazywana elektrodą kalomelową (elektroda o stałym, niezależnym od pH potencjale). Elektrody szklana i kalomelowa, tzn. elektrody pomiarowa i odniesienia, tworzą wspólnie łańcuch pomiarowy do wzmacniacza pomiarowego pH.
Potencjał elektrody szklanej Eszkl określany jest wzorem:
E0szkl jest potencjałem standardowym elektrody szklanej, który zależy od jej budowy, a przede wszystkim szkła, z którego zbudowano elektrodę i dlatego może zmieniać się w czasie.
Mierniki stosowane do pomiarów, nazywane pehametrami, są wyskalowane bezpośrednio w jednostkach pH. Ze względu na zmienność potencjału standardowego elektrody szklanej E0szkl, pehametry wymagają kalibrowania przy pomocy roztworów buforowych o stałym pH.
Wyniki pomiarów:
VNaOH (ml) |
pH buforu |
pH zmierzone |
VNaOH (ml) |
pH buforu |
pH zmierzone |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wykres:
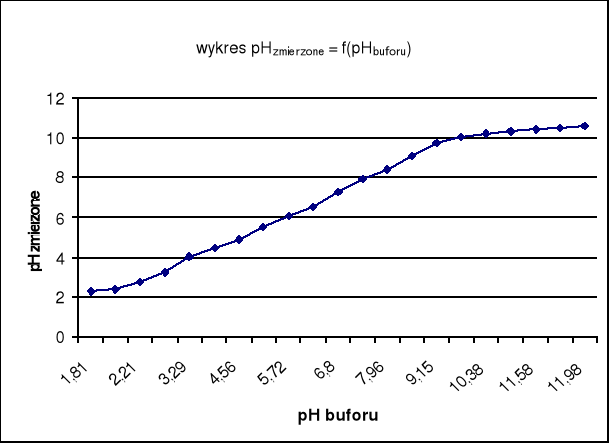
Wnioski:
Z analizy wykresu wynika, że zakres aktywności jonów wodorowych w roztworze (zakresu pH roztworu), dla którego potencjał elektrody szklanej zmienia się prostoliniowo, kończy się przy pH równym 9,5. Powyżej tej wartości roztwór jest na tyle alkaliczny że istnieje możliwość zmiany właściwości szkła co powoduje zakłócenia liniowej zależność potencjału od pH buforu , podobne zakłócenia mają miejsce przy pH < 3,29. Wynika z tego, że elektroda szklana nie powinna być stosowana zarówno dla roztworów silnie kwasowych jak i mocno zasadowych.
Wyszukiwarka
Podobne podstrony:
Moje Ćw 24, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizycz
ch fizyczna 13, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fi
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
Fizyczna 43, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
sprawko15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
22 wstęp teoretyczny 2015, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4
Wykres zaleznosci temperatury kalorymetru od czasu, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywi
chemia zywnos, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia Żyw
ChZywnosci - sciaga, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chem
chem zyw sciagi 2003, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Che
Harmonogram 2015 TECHN, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr I, M
sprawozdanie z soku, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 6, Ogól
skrobia 4, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 6, Technologia Ży
owoce cz. 5, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 6, Technologia
więcej podobnych podstron