PK WIiTCh GR. 34 Zespół nr 1 |
Ćwiczenie: 2 |
Data: 26.10.2000 |
1. Rynduch Zygmunt 2. Mierzwa Rafał 3. Mielnik Michał
|
Temat: Wyznaczanie krzywych ciecz- para dla roztworów doskonałych. |
Ocena: |
CZĘŚĆ TEORETYCZNA
Poszczególne składniki układu ciecz-para znajdujące się w równowadze muszą spełniać warunek:
mAroztw = mAgaz
Wychodząc z takiego założenia można wyprowadzić prawo, które podał Raoult:
pA = pAo * xA
Można stwierdzić doświadczalnie, że w układzie złożonym z roztworu idealnie rozcieńczonego i pary nad nim prawo Raoulta najlepiej stosuje się do rozpuszczalnika, a do substancji rozpuszczonej najodpowiedniejsze jest prawo Henry˘ego:
xi = Ki * pi
Z prawa Raoulta możemy policzyć ciśnienia cząstkowe składników w fazie gazowej, pozostających w równowadze w określonej temperaturze z roztworem o znanym składzie. Istnieją trzy możliwe wykresy w układzie p-x :
spełniający prawo Raoulta- jest to linia prosta
dodatnie lub ujemne odchylenie od prawa Raoulta lecz bez ekstremum - krzywa
dodatnie lub ujemne odchylenie od prawa Raoulta z wyraźnie zaznaczonym ekstremum - krzywa
Odchylenia te spowodowane są różnymi oddziaływaniami pomiędzy cząsteczkami A-A, B-B, a A-B.
Destylacja jest procesem fizykochemicznym polegającym na ogrzewaniu roztworu wieloskładnikowego do temperatury wrzenia pod stałym lub programowanym ciśnieniem zewnętrznym, a następnie skraplaniu par pozostających w równowadze z roztworem w chłodnicy i odbieralniku otrzymanego w ten sposób destylatu. Proces ten służy do rozdzielania składników, a podstawowym warunkiem stosowania tej metody jest, by skład pary różnił się od składu cieczy
.
CZĘŚĆ PRAKTYCZNA
1. Napełnić aparat około 40 cm3 roztworu
2.Doprowadzić układ do wrzenia.
3.Odczekać aż temperatura się ustabilizuje.
4.Pobór próbek:
-pobrać próbkę destylatu
-pobrać próbkę cieczy wrzącej
5.W ten sam sposób wykonać pomiary dalszych próbek.
6.Pomiary stężeń wykonać metodą refraktometryczną.
WYNIKI I OBLICZENIA
Ciśnienie atmosferyczne: patm=748 mmHg (997,33 hPa)
Temperatura otoczenia: Totocz=20 oC (293 K)
Temperatura wrzenia n-heksanu: Tw=68,7 oC (341,9 K)
Temperatura wrzenia toluenu: Tw=110,6 oC (383,6 K)
Korzystając z wykonanego wykresu zależności współczynnika załamania światła od stężenia będziemy mogli wyznaczyć stężenia otrzymanego destylatu i wrzącej cieczy.:
Otrzymane wyniki poddajemy weryfikacji obliczając teoretyczny skład pary będącej w równowadze z cieczą.
Z prawa Raulta mamy:
p = pa + pb
pa = pao * Xa
Gdzie:
p-ciśnienie całkowite
pa-ciśnienie cząstkowe toluenu
pao-prężność par toluenu w stanie czystym
Xa-ułamek molowy toluenu w roztworze ciekłym.
Z prawa Daltona mamy natomiast:
p = pa*Ya+ pb*Yb
Stąd:
Y a= p/pao * Xa
Gdzie: Ya-ułamek molowy toluenu w parze
Obliczamy poprawkę na zminę ciśnienia dla temperatury wrzenia.
Tw = Tw760 + ∆T/∆p *∆p
Stąd:
Temperatura wrzenia heksanu Th=68,7 + 0,042*(-12) = 68,2 oC (341,3 K)
Temperatura wrzenia toluenu Tt=110,6 + 0,046*(-12) = 110,0 oC (383,2 K)
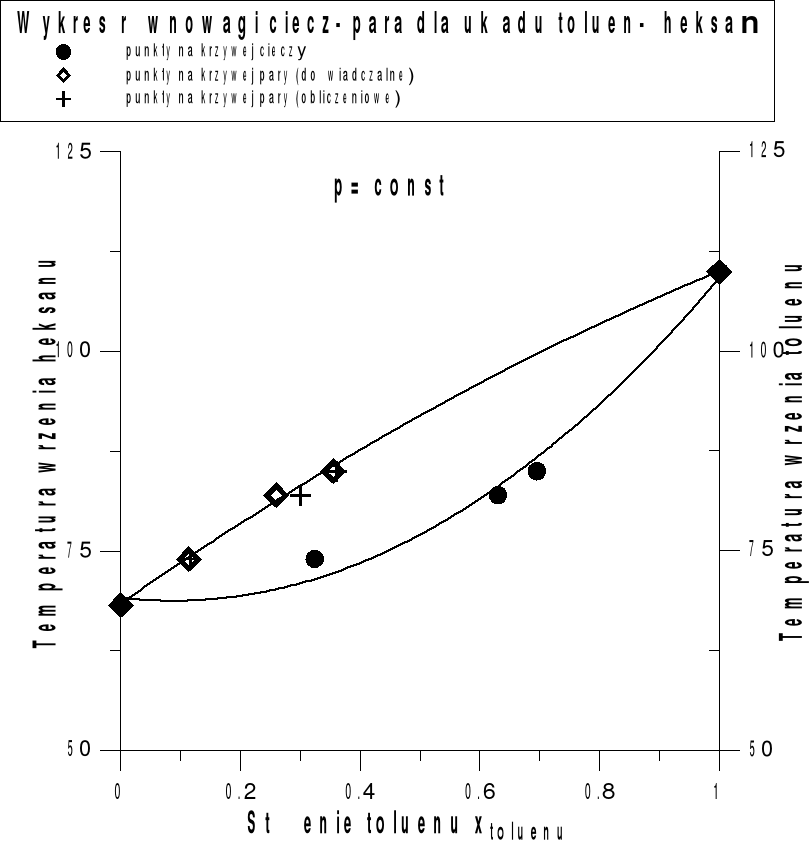
Mieszanina n-heksanu-toluen o temperaturze wrzenia 74,0 oC (347,2 K)
Lp. |
N20D dla cieczy |
N20D dla pary |
X0 toluenu w cieczy |
X0 toluenu w parze |
1 |
1,4087 |
1,3838 |
0,324 |
0,114 |
Mieszanina n-heksan-toluen o temperaturze wrzenia 82,0 oC (355,2 K)
Lp. |
N20D dla cieczy |
N20D dla pary |
X0 toluenu w cieczy |
X0 toluenu w parze |
1 |
1,4451 |
1,4008 |
0,630 |
0,260 |
Mieszanina n-heksan-toluen o temperaturze wrzenia 85,0 oC (358,2 K)
Lp. |
N20D dla cieczy |
N20D dla pary |
X0 toluenu w cieczy |
X0 toluenu w parze |
1 |
1,4589 |
1,4118 |
0,695 |
0,355 |
Stężenie toluenu w parze( obliczeniowe):
Temperatura wrzenia T [oC] |
Prężność pary czystego toluenu pTo |
Stężenie toluenu w parze yT |
74 |
270,27 |
0,117 |
82 |
359,46 |
0,300 |
85 |
386,49 |
0,360 |
Obliczenia wykonano według zależności:
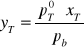
gdzie:
yT- stężenie toluenu w parze
pT0- prężność pary nasyconej nad czystym toluenem w temperaturze T
pb- ciśnienie atmosferyczne
xT- stężenie toluenu w mieszaninie wrzącej w temperaturze T pod ciśnieniem pb
WNIOSKI
Wraz z obniżeniem ciśnienia zewnętrznego maleje temperatura wrzenia substancji ciekłej.
Zjawisko to związane jest z tym, że układ osiąga temperaturę wrzenia w momencie, gdy prężność jego par jest równa ciśnieniu zewnętrznemu.
Prężność par nad cieczą oczywiście rośnie wraz ze wzrostem temperatury, wzrost wartości prężności par jest bardzo gwałtowny - postęp geometryczny.
Znając skład roztworu poddawanego wrzeniu można obliczyć, wykorzystując prawa Raulta i Daltona, skład równowagowej pary.
Periodyczna destylacja prosta może być użyta jako metoda rozdzielania dwóch substancji, które tworzą ze sobą układ zeotropowy.
Wyszukiwarka
Podobne podstrony:
praca magisterska wa c 7768
7768
7768
7768
7768
7768
miernictwo1 niepewnosci id 7768 Nieznany
7768
więcej podobnych podstron