W układzie izolowanym o temperaturze 273 K, 1 mol gazu podlega izotermicznemu sprężaniu od ciśnienia 1,01⋅107 Pa (100 atm) do ciśnienia 1,01⋅106 Pa (10 atm). Oblicz wartości: W, Q, ΔU, ΔH, ΔS i ΔG dla gazu, jeśli proces przebiega odwracalnie.
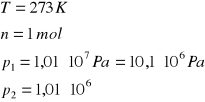
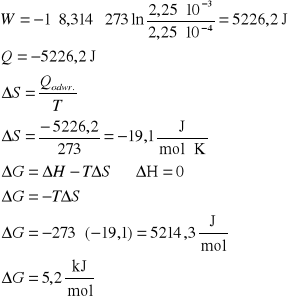
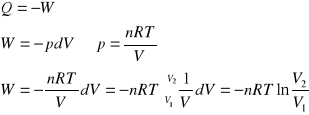
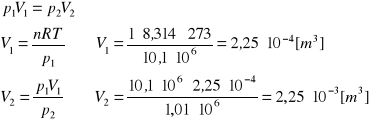
2. Obliczyć zmianę entropii spowodowaną zmieszaniem 5 kg wody o temperaturze T1=353 K z 10 kg 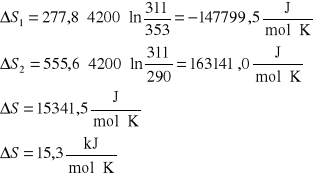
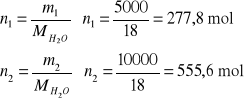
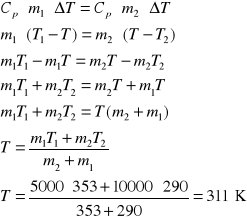
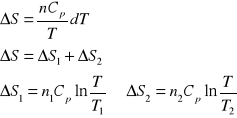
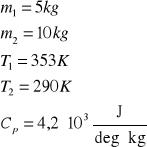
wody o temperaturze T2=290 K. Przyjąć, że pojemność cieplna wody jest stała i równa 4,2 ⋅103 J/deg kg.
3. Stała równowagi Kc reakcji H2 + I2 = 2HI w temperaturze 693 K wynosi 50. Czy będzie zachodzić synteza jodowodoru jeżeli gazy zmieszamy w następujących proporcjach:
[H2]= 2 kmol/m3, [I2]= 5 kmol/m3, [HI]= 10 kmol/m3
[H2]= 1,5 kmol/m3, [I2]= 0,25 kmol/m3, [HI]= 5 kmol/m3
[H2]= 1,0 kmol/m3, [I2]= 2 kmol/m3, [HI]= 10 kmol/m3
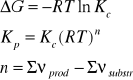
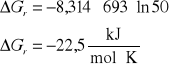
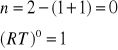
H2 + I2 = 2HI
![]()
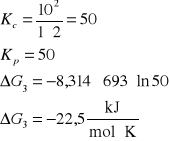
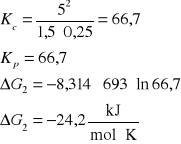
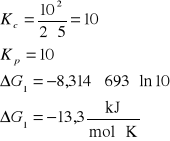
a) b) c)
![]()

4. W temperaturze 313 K prężność par dwuchloroetanu i benzenu wynoszą odpowiednio 2,066 ⋅ 104 Pa i 2,433 ⋅ 104 Pa. Pod jakim ciśnieniem będzie wrzeć mieszanina zawierająca 40% molowych benzenu i jaki będzie skład pary.
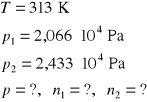

Po różnych przekształceniach dochodzę do
![]()
i nie mam pojęcia co dalej.....
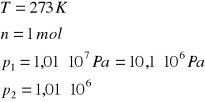
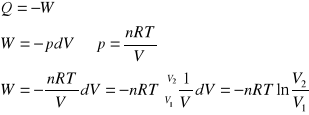
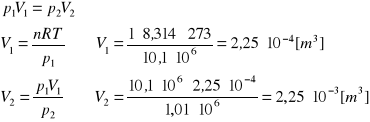
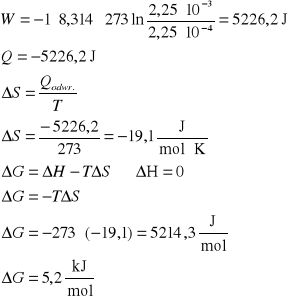
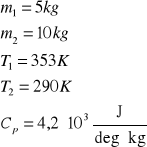
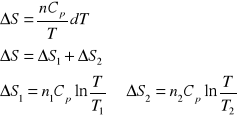
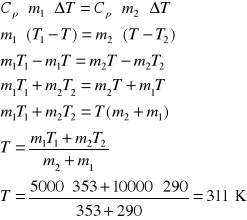
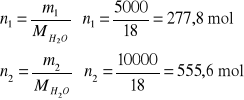
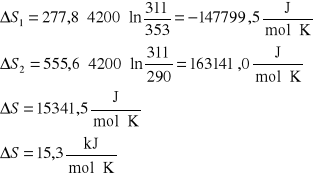
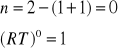
![]()
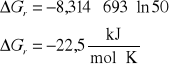
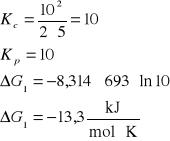
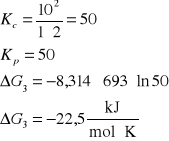

![]()
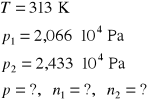

![]()
Wyszukiwarka
Podobne podstrony:
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Katalizatory - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
wielkości molowe-odp na pytania, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (Na, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga na zaliczenie laboratorium u mgr. Pacławskiego, Chemia Fizyczna, chemia fizyczna- laborki roz
Grupy główne i podgrupy układu okresowego pierwiastków, Chemia Fizyczna, chemia fizyczna- laborki ro
Ściąga do metali z hutnictwa i nie tylko, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Wodorotlenosole, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
ogniwa chemiczne, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
elektrolity, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (C, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Liczby przenoszenia, Chemia Fizyczna, chemia fizyczna- laborki rozne, Liczby przenoszenia
okładka-sb lab 15, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
oddana, Chemia Fizyczna, chemia fizyczna- laborki rozne, pH
!!!!!!!!destylacja, Chemia Fizyczna, chemia fizyczna- laborki rozne, destylacja
więcej podobnych podstron