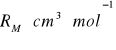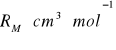nr. ćwiczenia: 5 |
temat ćwiczenia: Refraktometria |
|||
imię i nazwisko:
|
nr. zespołu:
|
Wydział: WTiICH Technologia chemiczna |
||
data:
|
ocena:
|
podpis:
|
||
1. Cel ćwiczenia
Wyznaczanie refrakcji grup funkcyjnych z pomiarów współczynnika załamania światła niżej wymienionych alkoholi:
metylowy
n-propylowy
izopropylowy
n-butylowy
n-amylowy
n-heksylowy
benzylowy
glikol etylenowy
Określenie wzoru strukturalnego związku o wzorze sumarycznym C4H8O2.
2. Przebieg pomiarów
Dla każdego z podanego zestawu alkoholi bada się współczynnik załamania światła w temperaturze pokojowej przy użyciu refraktometru Abbego. Zakres pomiarów współczynników mieści się w granicach 1,300-1,700 z dokładnością 1-2×10-4 i podziałką skali do 0,001. Zasadniczymi częściami refraktometru są: ogrzewana budowa pryzmatyczna w skład której wchodzi pryzmat oświetlający, luneta do obserwacji linii granicznej pola jasnego i ciemnego z wbudowanym układem pryzmatów Amiciego do znoszenia barwnej lini rozdzielającej pola pomiarów dyspersji średniej oraz mikroskop odczytowy ze skalą pomiarową.
Kolejne próbki nanosi się pipetą, którą należy każdorazowo po użyciu przemyć alkoholem metylowym i wysuszyć.
W celu wyznaczenia wzoru strukturalnego badanej substancji organicznej o wzorze sumarycznym C4H8O2 należy określić jej gęstość metodą piknometryczną oraz współczynnik załamania światła.
4. Sprawdzanie refraktometru
Na początku sprawdziłem czystość dolnej przezroczystej płytki i płytki górnej. Stwierdzone zanieczyszczenia usuwam szmatką i spłukuje woda destylowaną, po przechyleniu refraktometru. Na dolną płytkę nanoszę szklaną bagietką ok. 0,5cm3 wody destylowanej. Następnie ustawiam przyrząd do światła i patrząc przez okular, dolnym metalicznym lusterkiem oświetlam matówkę ze skrzyżowanymi liniami. Obracając pokrętłem umieszczonym z prawej strony przyrządu oświetlam zieloną skalę widoczną przez okular pod matówką. Obracając prawe pokrętło ustawiam ostrość i lewym pokrętłem poziomej granicy cienia ustawiam ostrą granice na skrzyżowaniu lini na matówce. Skala zielona w 20°C powinna wskazywać wartość 1,333 która odpowiada współczynnikowi załamania światła woda-powietrze.
3. Opracowanie wyników
Zależność pomiędzy współczynnikiem załamania światła, a gęstością i masą molową określa tzw. refrakcja molowa. Współczynnik załamania światła jest wielkością niemianowaną natomiast RM wyraża się w cm3/mol.
Refrakcję molową poszczególnych alkoholi obliczamy z poniższego równania:
![]()
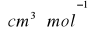
gdzie: M- masa cząsteczkowa
d- gęstość
np. dla alkoholu metylowego: ![]()
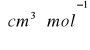
Analogicznie refrakcje molową obliczam dla pozostałych alkoholi a wyniki zestawiam w poniższej tabeli:
ALKOHOLE |
WZÓR SUMARYCZNY |
WSPÓŁCZYNNIK ZAŁAMANIA ŚWIATŁA |
MASA CZĄST.
|
GĘSTOŚĆ
|
REFRAKCJA MOLOWA
|
metylowy |
CH3OH |
1,3300 |
32,04 |
0,7866 |
8,3176 |
n-propylowy |
CH3CH2 CH2 OH |
1,3850 |
60,097 |
0,7995 |
17,6189 |
izopropylowy |
CH3CHOHCH3 |
1,3770 |
60,097 |
0,7810 |
17,6990 |
n-butylowy |
CH3 CH2 CH2 CH2OH |
1,3971 |
74,124 |
0,8098 |
22,0493 |
n-amylowy |
CH3(CH2)3CH2OH |
1,4002 |
88,15 |
0,8151 |
26,3456 |
n-heksylowy |
CH3(CH2)4CH2OH |
1,4170 |
102,18 |
0,8155 |
31,5106 |
benzylowy |
C6H5CH2OH |
1,5380 |
108,14 |
1,042 |
32,4468 |
glikol etylowy |
HOCH2CH2OH |
1,4244 |
62,07 |
1,110 |
14,2807 |
próba |
------- |
1,4100 |
88,10 |
1,0187 |
21,4270 |
Na podstawie znajomości R oraz wzorów cząsteczkowych poszczególnych alkoholi obliczamy refrakcję molową grup -CH2-, -C-H, -OH, -O- (w grupie OH), pierścienia aromatycznego (benzenowego), oraz wiązania podwójnego pierścienia benzenu.
Ważną własnością refrakcji molowej jest jej addytywność. Mianowicie refrakcja molowa związku może być obliczona na podstawie znajomości wzoru i struktury cząsteczki, jako suma odpowiednich udziałów refrakcji atomów i inkrementów uwzględniających wielokrotne wiązania i pierścienie. Kilka takich wartości udziałów w cm3 podaje poniższa tabela:
C |
2,591 |
H |
1,028 |
-CH- |
3,619 |
-CH2- |
4,647 |
-CH3- |
5,653 |
OH |
2,646 |
-O- (gr.hydroks.) |
1,967 |
C=C |
1,575 |
sześcioczłonowy pierścień węglowy |
-0,15 |
Tab. Wartości udziałów atomów i wiązań w refrakcji molowej
Każdy swój typ wiązania wnosi swój udział liczbowy do refrakcji molowej. Dlatego mierząc refrakcję molową bezpośrednio całej cząsteczki i porównując otrzymany wynik z wartością obliczoną teoretycznie na podstawie danych z odpowiednich tabel, można wyciągnąć wnioski dotyczące budowy cząsteczki danej substancji.
Łatwość oznaczenia współczynnika załamania światła powoduje, że refrakcje molową stosuje się do charakterystyki danego związku, do oznaczania jego czystości oraz oznaczania jego stężenia w mieszaninie.
Cząsteczki o podwójnych wiązaniach sprzężonych wykazują podwyższoną wartość refrakcji tzw. egzaltację, podwyższonej polaryzowalności zdelokalizowanych elektronów. Oznaczone doświadczalnie wartości refrakcji molowej są większe od obliczonych przez sumowanie udziałów.
Przykładowo w tabeli przedstawiliśmy porównanie wyników refrakcji molowych wybranych alkoholi wyznaczonych doświadczalnie oraz obliczonych przez sumowanie udziałów składowych atomów i ich ugrupowań:
ALKOHOLE |
WZÓR SUMARYCZNY |
REFRAKCJA MOLOWA OZNACZCONA DOŚWIADCZALNIE |
REFRAKCJA MOLOWA OBLICZONA PRZEZ SUMOWANIE UDZIAŁÓW |
metylowy |
CH3OH |
8,3176 |
8,2990 |
n-propylowy |
CH3CH2 CH2 OH |
17,6189 |
17,5870 |
n-butylowy |
CH3 CH2 CH2 CH2OH |
22,0493 |
22,24 |
Zgodność uzyskanych wartości (możliwy błąd w granicach kilku cm3 na mol) przemawia za słusznością przyjętego wzoru strukturalnego.
Gęstość badanej substancji d obliczyłem ze wzoru:
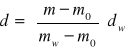
gdzie: m- masa badanej substancji w piknometrze
mw- masa wody w piknometrze
mo- masa próżnego piknometru
dw- gęstość wody w temperaturze pomiaru
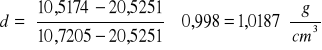
Na podstawie wyznaczonej gęstości i współczynnika załamania światła badanej substancji organicznej o wzorze sumarycznym C4H8O2 obliczyliśmy refrakcję molową z równania:
![]()
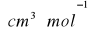
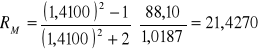
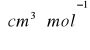
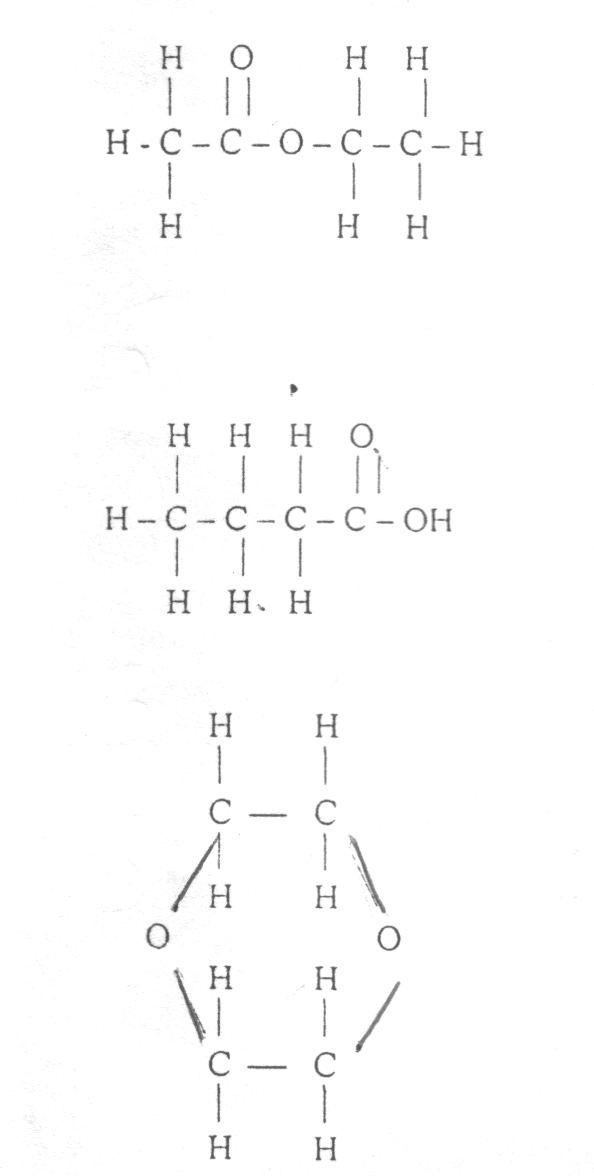
Na podstawie danych literaturowych obliczyliśmy addytywnie refrakcję molową dla niżej wymienionych związków o składzie sumarycznym:
![]()
![]()
![]()
W poniższej tabeli porównałem wartość refrakcji i gęstości badanej substancji znalezione doświadczalnie z wartościami refrakcji obliczonymi na zasadzie addytywności wiązań i atomów dla wymienionych izomerów strukturalnych i gęstości znalezionych w tablicach.
|
REFRAKCJA MOLOWA
|
GĘSTOŚĆ
|
OCTAN ETYLU |
22.153 |
0.8945 |
KWAS MASŁOWY |
22,169 |
0,943 |
DIOXAN |
22,116 |
1,035 |
PRÓBA |
21,427 |
1,0187 |
1
Wyszukiwarka
Podobne podstrony:
ćwiczenia laboratoryjne nr 2
Prezentacja laboratorium nr 2
Laboratorium nr 5 wskaYniki Nieznany
Sprawozdanie nr 3 (3), sem II, Podstawy Technologii Okrętów - Wykład.Laboratorium, Laboratorium nr 3
Ćwiczenie laboratoryjne nr 6 materiały
Automatyka Laboratorium Nr 1 id 73181 (2)
Laboratorium nr 8 dziedziczenie Nieznany
Laboratorium nr 4 funkcje cd id Nieznany
Fizyka - Laboratorium Nr 1 - Mostek Wheatstone'a, Studia, Sem I OiO, Fizyka, Labki, Mostek Wheatston
Sprawozdanie nr 2 (2) Metoda Brinella, sem II, Podstawy Technologii Okrętów - Wykład.Laboratorium, L
laboratorium nr 4
laboratorium nr 20
Laboratorium nr 2 zagadnienia
laboratorium nr 2
26, moja lab 26, ?WICZENIE LABORATORYJNE NR 26.
26, wstep, ĆWICZENIE LABORATORYJNE NR 26.
Dodatkowe nr 1 (1), sem II, Podstawy Technologii Okrętów - Wykład.Laboratorium, Laboratorium nr 1 (1
Zagadnienia na kolokwium z laboratoriów nr 2 by G.K., Mikrobiologia przemysłowa
28, READY28, ˙WICZENIE LABORATORYJNE NR 28.
laboratorium nr 4 edytor vi
więcej podobnych podstron