Uniwersytet Zielonogórski
Wydział Inżynierii Lądowej
i Środowiska
INSTYTUT BudownictwA
C h e m i a
ĆWICZENIA LABORATORYJNE
Ćwiczenie numer 4
„Ocena przydatności wody do produkcji betonów i zapraw”
Rok akademicki 2004/2005
SPIS TREŚCI
I. Część ogólna.
Przedmiot badania.
Zadanie do wykonania.
Cel ćwiczenia.
Metoda oznaczenia.
II. Część teoretyczna.
Wymagania szczegółowe stawiane dla wody zarobowej według normy PN-EN-1008-2004
Zastosowanie szkła wodnego w budownictwie.
Mechanizm wiązania i twardnienia spoiw krzemianowych.
III. Część doświadczalna.
Skrócony opis przeprowadzonych badań, obliczenia i wyniki.
Oznaczenie zawartości wody i szkła sodowego w procentach wagowych.
Oznaczenie zawartości tlenku sodowego w procentach wagowych.
Przebieg i wyniki miareczkowania.
Obliczenie miana titranta wyrażonego w gramach składnika oznaczonego na 1 cm3 jego objętości.
Wyniki oznaczenia.
Oznaczenie zawartości tlenku krzemowego w procentach wagowych.
Obliczenie modułu szkła wodnego.
Tabelaryczne zestawienie wyników badań.
I. Część ogólna.
Przedmiot badania - szkło wodne.
Zadanie do wykonania - oznaczenie modułu szkła wodnego.
Cel ćwiczenia.
3.1 Poznanie podstaw fizykochemii spoiw budowlanych opartych na szkle wodnym tj. spoiw krzemianowych.
3.2. Poznanie chemicznej analizy ilościowej zwanej miareczkowaniem alkacymetrycznym.
II. Część teoretyczna.
Otrzymywanie szkła wodnego.
Szkło wodne otrzymywane jest z mieszaniny dwóch surowców:
jeden dostarcza tlenku krzemu SO2,
drugi dostarcza tlenku sodu Na2O lub potasu K2O.
W praktyce wykorzystuje się piasek kwarcowy oraz węglan sodu lub potasu, względnie wodorotlenek sodu lub potasu. Gdy do produkcji szkła wodnego stosuje się surowiec będący nośnikiem tlenku sodu wówczas otrzymuje się szkło wodne sodowe; natomiast, gdy do produkcji stosuje się surowiec będący nośnikiem tlenku potasu, wówczas otrzymujemy szkło wodne potasowe.
Otrzymywanie:
surowce miesza się w takich ilościach wagowych, aby stosunek ilości moli SiO2 do ilości moli Na2O lub K2O zawartych w mieszaninie był z góry określony,
uzyskaną mieszaninę surowcową miesza się i rozdrabnia, a następnie poddaje obróbce termicznej w temperaturze powodującej jej całkowite stopnienie, uzyskuje się wodny roztwór stopu w postaci bezbarwnej, syropowej cieczy o odczynie zasadowym,
uzyskany stop gwałtownie się schładza przez wlanie do kadzy wypełnioną wodą w wyniku czego stop zestala się w postaci zgranulowanej masy szklanej,
następnie stop mieli się i rozpuszcza w wodzie w warunkach podwyższonej temperatury i ciśnienia.
Zastosowanie szkła wodnego w budownictwie.
W budownictwie stosuje się głównie szkło wodne sodowo - wapniowe („szkło zwykłe”) o zawartości SiO2 > 70%, Na2O 15 - 17% oraz CaO 0.5 - 8%. Szkło budowlane jest wytwarzane w postaci szkła płaskiego ciągnionego lub walcowego, a także formowanego na powierzchni stopionego metalu („float”), oraz szkła profilowanego; wytwarza się także kształtki szklane, szkło piankowe (spieniane, np. w wyniku rozkładu CaCO3 → CaO + CO2↑) oraz włókniste materiały szklane.
Szkło wodne znajduje szerokie zastosowanie praktyczne w różnorodnych gałęziach przemysłu - przemyśle papierniczym, mydlarskim, włókienniczym, drzewnym, spożywczym. Impregnowane za pomocą szkła wodnego wyroby drewniane i tekstylne stają się trudno palne, gdyż w czasie wysychania wytwarza się galaretowata powłoka kwasu krzemowego, która działa izolująco. Dlatego impregnuje się często szkłem wodnym materiały przeznaczone na dekoracje teatralne. Zestawy szkło wodne - fluorokrzemian o wypełniacz kwarcowy są stosowane jako kity i zaprawy do wykonywania kwasoodpornych posadzek i wypraw. Kompozyty takie są odporne na suche środowisko kwaśne (np. gazy kominowe). W środowisku wodnym są nietrwałe.
Mechanizm wiązania i twardnienia spoiw krzemianowych.
Procesy zachodzące podczas wiązania krzemianowego:
Spoiwa krzemianowe powstają w skutek wymieszania szkła wodnego z mączką kamienną zawierającą fluorokrzemian sodowy lub potasowy. Mączka ta stanowi przemielony andezyt, kwarcyt lub piasek kwarcowy z dodatkiem fluorokrzemianu sodowego. Mieszanina mączki kamiennej ze szkłem wodnym ma właściwości wiążące, a po stwardnieniu charakteryzuje się odpornością na działanie kwasów. Czas wiązanie wynosi około 16 godzin.
III. Część doświadczalna.
7. Skrócony opis przeprowadzonych badań, obliczenia i wyniki.
7.1. Oznaczenie zawartości wody i szkła sodowego w procentach wagowych.
Do tygielków nr 76 i 77 o znanej masie wkropiliśmy ok. 20 kropel otrzymanego do badania szkła wodnego. Tygielki z zawartością zważyliśmy. Następnie włożyliśmy je do pieca i po ostygnięciu ponownie zważyliśmy.
Dane obliczeniowe:
Nr tygielka |
Masa tygielka |
Masa tygielka i próbki przed prażeniem |
Masa tygielka i próbki po prażeniu |
Masa próbki przed prażeniem |
Masa próbki po prażeniu |
Ubytek masy |
76 |
58,461 g |
60,791 g |
59,493 g |
2,330 g |
1,032 g |
1,298 g |
77 |
59,052 g |
61,256 g |
60,035 g |
2,204 g |
0,983 g |
1,221 g |
dla tygielka nr 76
2,330 - 100% 2,330 - 100%
1,032 - S1 1,298 - W1
1,032 1,298
S1 = 100%= 44,29% W1 = 100%= 55,71%
2,330 2,330
dla tygielka nr 79
2,204 - 100% 2,204 - 100%
0,983 - S2 1,221 - W2
0,983 1,221
S2 = 100%= 44,60% W2 = 100%= 55,40%
2,204 2,204
Średnia zawartość wody (W) i szkła sodowego (S) w % wag.
S = (44,29 + 44,60) / 2 = 44,44 %wag
W = (55,71 + 55,40) / 2 = 55,56 %wag
7.2. Oznaczenie zawartości tlenku sodowego (N) w procentach wagowych.
7.2.1. Przebieg i wyniki miareczkowania.
Do wymytej zlewki o masie 195,229 g wkropiliśmy ok. 20 kropel badanego szkła wodnego i ponownie zważyliśmy uzyskując masę 197,604 g. Badana próbka miała masę 2,375 g. Następnie do zlewki dodaliśmy ok.100 cm3 gorącej wody i wymieszaliśmy (w celu rozpuszczenia szkła wodnego). Zawartość zlewki przenieśliśmy bez straty do kolby miarowej i dopełniliśmy wodą destylowaną do 250 cm3 i wymieszaliśmy. Z tak przygotowanego roztworu pobraliśmy 50 cm3 badanej cieczy i wlaliśmy do zlewki. Potem dodaliśmy ok. 6 kropel oranżu metylowego. Następnie miareczkowaliśmy roztworem HCl 0,1 aż do zmiany barwy z żółtej na pomarańczową z odcieniem różu. Ilość zużytego titranta w każdym z dwuch miareczkowań wynosiła 18,6 cm3.
7.2.2. Obliczenie miana titranta wyrażonego w gramach składnika oznaczonego na 1 cm3 jego objętości.
Na2O+2HCl2Nacl+H2O
masa atomowa Na = 23g.
masa atomowa O = 16g.
masa atomowa H = 1g
masa atomowa Cl = 35,5 g
masa cząsteczkowa Na2O =
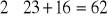
gmasa cząsteczkowa 2HCl = 2(1+35,5) = 73g
Cmol = n/(m+V) m = 3,65g
3,646g HCl 1000cm3
x 1cm3
x = 0,00365g HCl
73g HCl 62g Na2O
0,00365g HCl K.
K. = (0,00365 . 62) / 73
K = 0,0031g Na2O
Oznaczenie zawartości tlenku sodowego (N) w procentach wagowych.
V K 5
N = 100%
m
V - objętość kwasu zużytego do miareczkowania,
K - miano roztworu kwasu wyrażone w gramach Na2O na 1cm3 kwasu,
m - masa próbki szkła wodnego w g,
5 - współczynnik przeliczeniowy;
7.2.3. Wyniki oznaczenia.
18,6 x 0,0031 x 5
N = 100%
2,375
N = 12,14 %
7.3.Oznaczenie zawartości tlenku krzemowego (K) w procentach wagowych.
K = S - N
K = 44,44 - 12,14 = 32,30
K = 32,30 %
7.4. Obliczenie modułu szkła wodnego (Msw).
Msw = ilość moli SiO2 / ilość moli Na2O = K · MN / N · MK
MN - masa molowa tlenku sodu,
MK - masa molowa tlenku krzemu,
Msw = (0,3230 · 62) / (0,1214 · 60) = 2,74
Msw = 2,74
7.5. Tabelaryczne zestawienie wyników badań.
|
Wielkość oznaczana |
Wynik |
1 |
Woda (W) |
55,56 % wag |
2 |
Szkło wodne (S) |
44,44 % wag |
3 |
Tlenek Na2O (N) |
12,14 % wag |
4 |
Tlenek SiO2 (K) |
32,30 % wag |
5 |
Moduł szkła wodnego (Msw) |
2,74 |
Grupa laboratoryjna: 10
Podgrupa: B
Zespół numer:
39
Wyszukiwarka
Podobne podstrony:
Sprawozdanie biochemia 2, Studia, I semestr II rok, Biochemia, Różne
SEM-15WF2011 - Metabolizm nukleotydow pur i pyr, Studia, I semestr II rok, Biochemia, Różne
TEST BHP rozwiazania, Studia, I semestr II rok, Biochemia, Różne
SEM-15WF2011 - Metabolizm nukleotydow pur i pyr, Studia, I semestr II rok, Biochemia, Różne
anatomiaegz, Studia, I semestr II rok, Anatomia funkcj. człowieka
Wymagania do kolokwium zalicz, Studia, I semestr II rok, Techniki laboratoryjne
anatomiaegz, Studia, I semestr II rok, Anatomia funkcj. człowieka
Metrologia Spraw-1, Studia, SiMR, II ROK, III semestr, Metrologia i zamienność, Metrologia, Metrolog
Sprawozdanie z projektu nr 6, Studia GiG agh, Rok II, Geologia inżynierska
Geodezja sprawozdanie nr 6, Studia, 1 rok, od Magdy, geodezja 1, Geodezja II, Geodezja (Kuba)
Metrologia Spraw-3, Studia, SiMR, II ROK, III semestr, Metrologia i zamienność, Metrologia, Metrolog
sprawko trans R, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elekt
Metrologia Spraw-3.1, Studia, SiMR, II ROK, III semestr, Metrologia i zamienność, Metrologia, Metrol
Materialy do cw lab II semestr, studia, Zdrowie Publiczne, II rok, Biochemia
PIII - teoria, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektro
Sprawozdanie Nr. 8 (ilościowa), AGH WIMiC, Rok II, Chemia Nieograniczna ROK II, Laboratoria
elektra P4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
elektra M4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
Egz mech 2(1), Studia, SiMR, II ROK, III semestr, Mechanika Ogólna II, Mechanika 2, Mechanika
więcej podobnych podstron