Wykłady z chemii fizycznej dr hab. Jan Gutowicz
18.02.2005
Tematy wykładów:
Oddziaływania międzycząsteczkowe.
Dwuwarstwa lipidowa.
Promieniowanie elektromagnetyczne, spektroskopia absorbcyjna.
Zimna emisja promieniowania elektromagnetycznego. Luminescencja. Podstawy spektroskopii emisyjnej.
Termodynamika układów biologicznych, funkcje termodynamiczne. Równowaga termodynamiczna.
Komórka jako układ termodynamiczny otwarty. Elementy bioenergetyki.
Termodynamiczny opis reakcji chemicznej przemian fazowych.
Termodynamiczny opis zjawisk transportu masy (dyfuzja, osmoza, elektrodyfuzja).
Transport bierny i aktywny.
Szybkość reakcji chemicznej. Kinetyka chemiczna.
Mechanizmy molekularne katalizy chemicznej.
Roztwory koloidowe.
Reakcje red-ox.
1. Oddziaływania i wiązania międzycząsteczkowe (to nie to samo)
Aby rozerwać wiązanie wewnątrz-cząsteczkowe trzeba dostarczyć bardzo dużą ilość energii; poza wiązaniami zachodzącymi pomiędzy atomami, występują również słabsze wiązania międzycząsteczkowe.
Cząsteczki niektórych substancji mogą tworzyć wiązania pomiędzy sobą. Wiązania te są dość słabe i właśnie tym się od mocnych wiązań wewnątrz-cząsteczkowych, które są wysycone. Cechą charakterystyczną wiązani wewnątrz-cząsteczkowych jest tworzenie cząsteczek o określonym składzie stechiometrycznym, mają one charakter kierunkowy (stąd określone kształty cząsteczek).
Wszystkie rodzaje energii występujące w atomach są skwantowane; im dalej od jądra, tym różnice energii są mniejsze (odległość pomiędzy wartościami progowymi energii zmniejsza się i skwantowanie w rezultacie przechodzi w ciągłość)
Wiązania pomiędzy atomami mają charakter sił elektromagnetycznych dlatego, że siły grawitacyjne są zbyt słabe (mała masa atomów), a siły jądrowe mają bardzo ograniczony zasięg (właściwie tylko w obrębie jądra). Istotną cechą tych sił jest ich zależność od odległości (są funkcjami odległości).
Oddziaływania międzycząsteczkowe opierają się również na siłach elektromagnetycznych. Można je opisać metodami klasycznymi (bo nie występuje już kwantowanie energii); stosuje się do tego prawo Culomba (cząsteczki na dużych odległościach można traktować jako model elektrostatyczny).
Dipol jest cząstką posiadającą dwa różnoimienne ładunki o tej samej wartości (na przeciwległych końcach). Odległość pomiędzy tymi ładunkami jest niezmienna. Dipol ma bardzo charakterystyczny układ linii pola.
Ogólnie rzecz biorąc wszystkie cząsteczki można przybliżyć do ładunku punktowego (np. jon) lub do dipolu (np. cząsteczka wody). Dipolowość cząstek zależy od różnicy elektroujemności pomiędzy atomami budującymi cząstkę (duża różnica występuje np. w przypadku wiązań kowalencyjnych spolaryzowanych). Cząsteczki wieloatomowe mogą być dipolami, gdy moment dipolowy wszystkich wiązań jest różny od zera.
Moment dipolowy to wektor o punkcie zaczepienia w środku ładunku ujemnego; jego wartość wyliczamy mnożąc wartość ładunku na biegunie przez długość wiązania [q • l ].
W przypadku wody mamy dwa momenty dipolowe; tylko dzięki temu, że woda jest cząsteczką nieliniową ma ona charakter dipolowy (suma wektorowa momentów dipolowych jest różna od zera).
Cząsteczki, które nie są dipolami mogą posiadać chwilowy moment dipolowy. Przykładowo jon może indukować moment dipolowy cząsteczki niedipolowej
Z punktu widzenia elektrostatyki ładunki punktowe przyciągają się lub odpychają.
2. Potoczne przykłady i dowody istnienia wiązań i oddziaływań międzycząsteczkowych:
stany skupienia inne, niż gazowy
lepkość
napięcie powierzchniowe
różne ciepła parowania
istnienie błon komórkowych
3. Rodzaje oddziaływań międzycząsteczkowych:
a) jon jon;
np. kryształ NaCl; energia tego oddziaływania jest odwrotnie proporcjonalna do odległości
![]()
U - energia; ε - przenikalność elektryczna próżni, q - ładunek
b) jon dipol indukowany;
np. pierścień benzenowy i jon NH3+
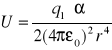
α - polaryzowalność cząsteczki
c) dipol dipol;
np. grupy karbonylowe
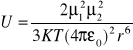
K - stała Boltzmana
d) dipol dipol indukowany;
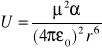
e) dipol indukowany dipol indukowany;
np. dwa pierścienie benzenowe
![]()
I - energia jonizacji cząsteczki
Siły przyciągające powodują zbliżanie się cząsteczek do siebie. Gdy cząsteczki znajdą się w małej odległości zaczynają działaś siły odpychające (też funkcje odległości).
Siły odpychające i przyciągające nie są siłami (funkcjami symetrycznymi).
Punktem równowagowym nazywamy miejsce, w którym siły przyciągania i odpychania równoważą się.
Wiązaniem nazywamy sytuację dwóch cząstek, w której zmiana odległości pomiędzy nimi powoduje drgania wokół odległości równowagowej (długości wiązania);
kowalencyjne 0,09 - 0,18 nm
jonowe ponad 0,28 nm
wodorowe 0,3 - 0,4 nm
Energią wiązania nazywamy energię potrzebną do rozerwania wiązania; jest ona zapisywana jako dodatnia (bo należy jej dostarczyć) i podawana w dżulach na mol [J/mol].
kowalencyjne 150 - 360 KJ/mol
jonowe (w wodzie) 10 - 20 KJ/mol
wodorowe 12 - 35 KJ/mol
siły van der Waalsa 2 - 50 KJ/mol
energia ruchów cieplnych 2,5 KJ/mol (średnio)
Oddziaływania międzycząsteczkowe rozciągają cząsteczkę. Struktury międzycząsteczkowe ą dynamiczne, wymagają ciągłej wymiany.
4. Klasyfikacja wiązań międzycząsteczkowych:
a) niespecyficzne
jonowe (z udziałem jonów)
van der Waalsa (z udziałem dipoli)
efekty hydrofobowe (gdy dużo cząsteczek)
b) specyficzne (cząsteczki są bliżej siebie, energia jest skwantowana)
wodorowe
kompleksy z przeniesieniem ładunku (charge transfer)
5. Wiązania wodorowe (mostek wodorowy / protonowy)
X-H•••:Y
Wodór związany kowalencyjnie (wiązaniem spolaryzowanym) z inną cząsteczką, łączy się z atomem innej lub tej samej cząsteczki o wolnej parze elektronowej. X i Y muszą być silnie elektroujemne (O, N, F, Cl, czasem S).
Wiązania wodorowe modyfikują własności fizykochemiczne substancji (wzrasta temperatura wrzenia i topnienia, rośnie przenikalność elektromagnetyczna).
Wiązania wodorowe występują między innymi w: H2O, NH3, białkach α i β, kwasach nukleinowych, KHF2, kwasach karboksylowych.
W wyniku występowania wiązań wodorowych pomiędzy cząsteczkami wody, substancja ta ma anomalne właściwości; lód jest strukturą bardzo regularną, w fazie ciekłej wiązania występują nieregularnie.
6. Wiązania w wyniku przeniesienia ładunku (EDA - elektrono - donorowo - akceptorowe)
D + A D•••A D+ •••A-
Wiązania tego typu najczęściej tworzą komponenty o stechiometrii 1:1. Wiązanie tworzy się, gdy ładunek elektronowy zostanie przeniesiony z jednej cząsteczki (donor) na drugą (akceptor). Zaangażowane są tu najczęściej wolne pary elektronowe lub elektrony π.
Energia tego wiązania zależy od warunków środowiska; dobrym przykładem występowania tego wiązania jest tzw. efekt solwatacyjny (lub hydratacyjny, jeśli rozpuszczalnikiem jest woda)
1
chemia fizyczna wykład z 18.02.2005
Wyszukiwarka
Podobne podstrony:
chf wykład 6, Studia, Chemia, fizyczna, wykłady
chf wykład 3, Studia, Chemia, fizyczna, wykłady
chf wykład 8, Studia, Chemia, fizyczna, wykłady
chf wykład 5, Studia, Chemia, fizyczna, wykłady
chf wykład 4, Studia, Chemia, fizyczna, wykłady
chf wykład 7, Studia, Chemia, fizyczna, wykłady
chf wykład 2, Studia, Chemia, fizyczna, wykłady
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
chem fiz, Studia, Chemia, fizyczna, examin
7, Studia, Chemia fizyczna, Laborki
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Chem fiz egz grupa A, Studia, Chemia fizyczna, Od Anki, egzaminy
2, Studia, Chemia fizyczna, Laborki
ćw2 - Napięcie powierzchniowe, studia, chemia fizyczna
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
Fizyczna I termin 22 VI 209, Studia, Chemia fizyczna, Od Anki
więcej podobnych podstron