Ciepło spalania związków organicznych |
|
Marcin Górski |
Data: |
Mirosław Dziergowski |
Zaliczenie: |
I. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie ciepła spalania związku organicznego w kalorymetrze automaty-cznym.
II. Zasada pomiaru
Pomiar polega na całkowitym spaleniu próbki w atmosferze tlenu pod ciśnieniem w bombie kaloryme-trycznej zanurzonej w wodzie i na pomiarze przyrostu temperatury tej wody.
Całość doświadczenia składa się z dwóch części:
Wyznaczenia stałej kalorymetru na podstawie bilansu cieplnego procesu spalania substancji wzorcowej (o znanym cieple spalania).
Wyznaczenia ciepła spalania substancji badanej.
Schemat aparatury
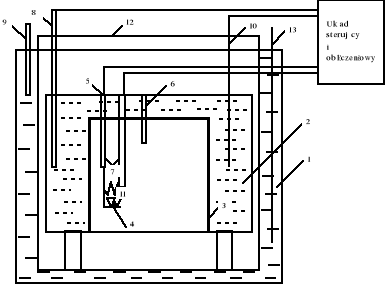
Płaszcz kalorymetru
Naczynie kalorymetryczne
Bomba kalorymetryczna
Tygiel z próbką do spalania
Zawór wlotowy
Zawór wylotowy
Elektrody
Termistor
Termometr zwykły
Mieszadło
Drucik wpasowany w próbkę
Pokrywa
Mieszadło ręczne do wyrównania temperatury w termostacie
Wyniki pomiarów
|
Symbol |
Próbka wz. naftalenu |
Próbka kwasu o-ftalowego |
Masa drutu zapłonowego przed spaleniem |
m1 [g]
|
0.0117 |
0.00970 |
Masa drutu zapłonowego po spaleniu |
m2 [g] |
0.0016 |
0.00260 |
Masa tygla |
m3 [g] |
5.0991 |
5.09745 |
Masa (tygiel+drut+subst.) |
m4 [g] |
6.1176 |
6.33570 |
Masa próbki |
m. [g] |
1.0185 |
1.23825 |
Temperatura próbki wzorcowej |
Temperatura próbki badanej |
||||
1.Okres |
2.Okres |
3.Okres |
1.Okres |
2.Okres |
3.Okres |
4.034 = T1 |
4.293 |
7.330 |
3.900 = T1 |
4.161 |
5.882 |
4.053 |
5.553 |
7.329 |
3.909 |
5.050 |
5.883 |
4.069 |
6.471 |
7.329 |
3.919 |
5.441 |
5.883 |
4.084 |
6.880 |
7.328 |
3.928 |
5.614 |
5.883 |
4.100 |
7.062 |
7.325 = T4 |
3.937 |
5.710 |
5.884 = T4 |
4.114 |
7.168 |
|
3.945 = T2 |
5.767 |
|
4.125 = T2 |
7.233 |
|
|
5.804 |
|
|
7.272 |
|
|
5.827 |
|
|
7.295 |
|
|
5.841 |
|
|
7.310 |
|
|
5.852 |
|
|
7.318 |
|
|
5.860 |
|
|
7.323 |
|
|
5.863 |
|
|
7.327 |
|
|
5.867 |
|
|
7.330 |
|
|
5.869 |
|
|
7.331 |
|
|
5.871 |
|
|
7.331 = T3 |
|
|
5.873 |
|
|
|
|
|
5.875 |
|
|
|
|
|
5.879 |
|
|
|
|
|
5.880 |
|
|
|
|
|
5.880 = T3 |
|
Obliczenie pojemności cieplnej kalorymetu K.
Aby wyznaczyć pojemność cieplną kalorymetru (stała kalorymetru) K, należy przeprowadzić w nim proces spalania związku organicznego o znanym cieplne spalania. W tym celu przeprowadzono w ka-lorymetrze proces spalania naftalenu C10H8, którego ciepło spalania pod stałym ciśnieniem w tempera-turze 20oC wynosi Qp= -5156.1 [kJ/mol] = -40282.031 [J/g].
Proces przebiega wg. reakcji:
C10H8 (s) +12O2g) → 10CO2 (g)+4H2O(c)
Obliczmy Qv naftalenu z zależności:
Qp= Qv + Δν(g)⋅RT
Δν(g) - różnica współczynników stechiometrycznych gazowych produktów i substratów reakcji spalania. Dla powyższego procesu różnica ta jest równa:
Δν(g) = 10-12 = -2.
Qv = Qp - Δν(g) ⋅RT = -5156100 [J/mol] - (-2)8.314 [J/mol⋅K] ⋅293 [K] =
= -5151230.34 [J/mol] = -40243.987 [J/g].
Obliczamy stałą kalorymetru K, wg. wzoru:
,gdzie:
- ciepło spalania naftalenu
- masa próbki [g]
m1 - masa drutu zapłonowego przed spaleniem [g]
m2 - masa drutu zapłonowego po spaleniu [g]
q - ciepło spalania drutu (6698.8 [J/g])
ΔT = T3-T2 = 7.331-4.125 = 3.206 [K]
; gdzie x - czas trwania okresu głównego.
czyli:
VI. Obliczenie ciepła spalania Qv kwasu o-ftalowego (C8H6O4; M=166 [g/mol]).
gdzie:
ΔT = 5.880-3.945 = 1.935 [K]
tak więc:
VII. Przeliczenie Qv kwasu o-ftalowego na Qp.
Reakcja spalania kwasu o-ftalowego przebiega zgodnie z reakcją:
C8H6O4(s) + 7.5O2 (g) → 8CO2 (g) + 3H2O(c)
Qp= Qv + Δν(g)⋅RT
Δν(g) = 8-7.5 = 0.5
Qp = -3272741.792 [J/mol] + 0.5⋅8.314 [J/mol⋅K]⋅298[K] = -3271523.791 [J/mol]=
= -3271.5237 [kJ/mol] = -3271.5 [kJ/mol].
Szacowanie błędu bezwzględnego i względnego [ΔQv].
Dane:
Qvwz = 40243,98 [J/g]
ΔT = T3 - T2 = 3,206 [K]
δ1 = -0,0095
δ2 = 0,0193
x - czas trwania okresu głównego
dla naftalenu = 16
dla kw. o-flalowego = 20
= 7,8⋅10-3
= 9⋅10-3
= 29,57
ΔQv =
IX. Wyniki obliczeń.
Substancja |
Obliczeniowe ciepło spalania pod p=const [kJ/mol] |
Tablicowe ciepło spalania pod p=const [kJ/mol] |
NAFTALEN |
- |
-5156.1 |
KWAS O-FTALOWY |
-3271.5 |
-3223.6 |
|
|
|
X. Wnioski
Jak widać wartość obliczeniowa ciepła spalania próbki (kw. o-ftalowy) pod p=const jest zbliżona do wartości tablicowej. Na różnice te mogło wpłynąć:
parowanie wody,
pozostałość azotu w powietrzu - tworzenie się tlenków.
1
Wyszukiwarka
Podobne podstrony:
Ciep-o rozpuszczania, technologia chemiczna, chemia fizyczna, srawozdania
Adsorpcja jodu na wŕglu, technologia chemiczna, chemia fizyczna, srawozdania
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
Punkt izoelektryczny, technologia chemiczna, chemia fizyczna, srawozdania
Liczby przenoszenia, technologia chemiczna, chemia fizyczna, srawozdania
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Szeregi Hoffmeistera, technologia chemiczna, chemia fizyczna, srawozdania
Napiŕcie powierzchniowe, technologia chemiczna, chemia fizyczna, srawozdania
Kriometria, technologia chemiczna, chemia fizyczna, srawozdania
Si-a jonowa, technologia chemiczna, chemia fizyczna, srawozdania
SEM ogniwa, technologia chemiczna, chemia fizyczna, srawozdania
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
Zadania sem.2, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
więcej podobnych podstron