A + B +….= Q + R + …..
substraty produkty
Miarą zaawansowania reakcji chemicznej jest stopień przereagowania
![]()
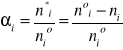
n*i- liczność substratu, która przereagowała
noi- początkowa liczność substratu
ni- aktualna liczność substratu
Reakcji powstawania produktu (prędkość v1) towarzyszy reakcja odwrotna- odtwarzania substratu (prędkość v2). W miarę wzrostu przereagowania substratu (α) maleje szybkość powstawania produktu (v1).
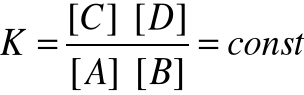
Szybkość v2 rośnie w miarę wzrostu ilości każdego z produktów. Gdy szybkości reakcji zrównają się ustali się stan równowagi termodynamicznej. Po osiągnięciu tego stanu α nie zmienia się już. Stan taki opisuje wyrażenie na stałą równowagi termodynamicznej (wartość stała w danej temperaturze).
Gdzie [X] oznacza wartość stężenia reagentu X w stanie równowagi (w jednostkach mol/dm3).DYSOCJACJA ELEKTROLITYCZNA- rozpad na jony elektrolitów w rozpuszczalniku polarnym. (Rozpuszczalnik polarny- taki, którego cząsteczki mają charakter dipoli elektrycznych)
Elektrolity mogą ulegać dysocjacji całkowicie lub częściowo w zależności od rodzaju elektrolitu, temperatury, stężenia roztworu i obecności innych jonów. → Elektrolit może mieć różny stopień dysocjacji.
Stopień dysocjacji- stopień przereagowania substratu w reakcji typu: A = B + C.
Np. H2CO3 = H+ + HCO-3
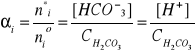
Elektrolity mocne (HCl, HNO3, NaOH, KOH, prawie wszystkie sole o ile rozpuszczają się w wodzie), to takie, dla których w niezbyt stężonych roztworach (tzn. c≤ 0,1 M ) α = 1 (100%).
Elektrolity słabe (HCN, H2CO3, wiele kwasów organicznych, NH4OH i wiele zasad organicznych), to te, które w roztworze wodnym o stężeniu równym 0,1M są zdysocjowane w niewielkim stopniu (α ≤ 3%).
Stała równowagi reakcji dysocjacji elektrolitycznej
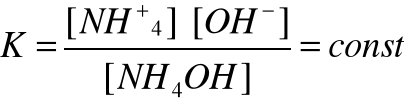
Np. NH4OH = NH+4 + OH-
II/ 2
____________________
Opracowała: Joanna Kosendiak
![]()
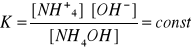
Wyszukiwarka
Podobne podstrony:
8.Dysocjacja elektrolityczna, Notatki AWF, Biochemia
10.Nazewnictwo, Notatki AWF, Biochemia
19.Budowa białek, Notatki AWF, Biochemia
Biochemia III, Notatki AWF, Biochemia, BIOCHEMIA - na koło
33.Łańcuch aminokwasowy, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
Biochemia Zagadnienia na III kolokwium, Notatki AWF, Biochemia, BIOCHEMIA - na koło
1.Reakcja chemiczna, Notatki AWF, Biochemia
13.Kwasy tłuszczowe, Notatki AWF, Biochemia
Pytania na koło (grupa 1-6), Notatki AWF, Biochemia, BIOCHEMIA - na koło
Metabolizm glikogenu, Notatki AWF, Biochemia
Cukrowce w wysiłkach, Notatki AWF, Biochemia
Wiązanie N-glikozydowe, Notatki AWF, Biochemia
2.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
Fruktoza, Notatki AWF, Biochemia
Biochemia - Na III kolokwium, Notatki AWF, Biochemia, BIOCHEMIA - na koło
6.Wodorotlenki, Notatki AWF, Biochemia
Monosacharydy - triozy, Notatki AWF, Biochemia
34.Reakcja transaminacji, Notatki AWF, Biochemia
więcej podobnych podstron