Protokół
z ćwiczenia 5-korozja metali I
Wydział Budownictwa, Architektury i Inżynierii Środowiska Budownictwo-Magisterskie |
Łukasz Nijaki |
data wykonania ćwiczenia: 18. 01. 2000 |
Grupa II |
prowadzący: magister Joanna Rychłowska |
godz. 8.15 |
PRZEBIEG DOŚWIADCZENIA:
Ćwiczenie składało się z trzech części:
rdzewienie żelaza
-należało przygotować 200 ml roztworu o składzie 3 % NaCl i 0,3 % H2O2 przez zmięszanie równych objętości 6% NaCl i 0,6% H2O2. Otrzymany roztwór rozlaliśmy do dwóch zlewek. W jednej umieściliśmy płytkę ze stali nierdzewnej, a w drugiej ze stali zwykłej.Płytki przed doświadczeniem powinny być odpowiednio wyczyszczone, odtłuszczone metanolem i osuszone. Należało je również zważyć z dokładnością do 0,001g i umieścić w przygotowanych roztworach na okres 45 min.Po tym czasie należało je znów osuszyć bibułą i zważyć.
wykonanie tlenowego ogniwa stężeniowego:
-w tej części należało na osuszoną papierem ściernym i odtłuszczoną w metanolu płytkę ze stali zwykłej nanieść kroplę wzkaźnika ferrykslylowego i obserwować zachodzące zmiany barwy w kropli.
Wyznaczanie potencjałów elktrod (Fe, Cu, Ni, Al )
Po mechanicznym oczyszczeniu i odtłuszczeniu płytek Fe, Cu, Ni, Al należało zbudować z nich i z elektrody kalomelowej ogniwo. Zbadać SEM zbudowanych ogniw. Mierzyć potencjał co 15 sekund od czasu zanurzenia elektrod w roztworze 3% NaCl w czasie 4 minut.
ANALIZA ĆWICZENIA:
a) Celem doświadczenia była obserwacja zmian na płytce od chwili zanurzenia w roztworze przez okres 45 minut. Z powodu braku czasu czas ten został skrócony do 40 minut. Płytka ze stali nierdzewnej nie zmieniła swego wyglądu przez cały czas trwania doświadczenia, natomiast płytka ze stali zwykłej pokryła się częściowo brunatnym nalotem już po kilku chwilach od zanurzenia. Obszar nalotu powiększał się, by po ok. 40 min. pokryć się nalotem w całości (barwa nie była jednakowa na całej powierzchni).
|
waga przed zanurzeniem do roztworu |
waga po wyjęciu z roztworu |
stal zwykła |
13,199 g |
13,184 g |
stal nierdzewna |
15,662 g |
15,653 g |
b) Po kilku minutach na obrzeżach kropli wystąpiło zabarwienie malinowe, z kolei wnętrze kropli zabarwiło się na niebiesko. Po osuszeniu płytki, w miejscu gdzie znajdowała się kropla, powstał pierścień o brunatnym kolorze.
c) W trzeciej części badaliśmy SEM ogniw. Wyniki zestawiłem w tabeli:
Czas (s) |
Cu |
Ni |
Al |
Fe |
15 |
0,127 |
0,137 |
0,448 |
0,021 |
30 |
0,128 |
0,156 |
0,439 |
0,021 |
45 |
0,127 |
0,167 |
0,437 |
0,042 |
60 |
0,125 |
0,174 |
0,435 |
0,054 |
75 |
0,124 |
0,179 |
0,435 |
0,057 |
90 |
0,124 |
0,184 |
0,431 |
0,064 |
105 |
0,124 |
0,187 |
0,430 |
0,068 |
120 |
0,124 |
0,190 |
0,428 |
0,070 |
135 |
0,122 |
0,193 |
0,428 |
0,073 |
150 |
0,122 |
0,195 |
0,430 |
0,076 |
165 |
0,122 |
0,197 |
0,434 |
0,079 |
180 |
0,121 |
0,198 |
0,434 |
0,080 |
195 |
0,121 |
0,196 |
0,431 |
0,082 |
210 |
0,120 |
0,198 |
0,435 |
0,084 |
225 |
0,120 |
0,200 |
0,432 |
0,088 |
240 |
0,119 |
0,200 |
0,432 |
|
CEL DOŚWIADCZENIA:
OPRACOWANIE WYNIKÓW:
WNIOSKI:
4. Wnioski:
a) Płytka ze stali nierdzewnej nie uległa korozji. Ubytek masy, który wykazało ważenie wynikać będzie z przejścia pewnej ilości jonów do elektrolitu: Fe→Fe2+ + 2e.
Płytka ze zwykłej stali w skutek przebywania w agresywnym środowisku - o dużym stężeniu O2 uległa korozji. Odnotowana zwiększona masa płytki wynika z osadzenia się rdzy na powierzchni płytki. Zaszły następujące reakcje:
Na anodzie: Fe→Fe2+ + 2e.
Na katodzie: 2H2O2→2H2O+O2
2H2O +O2+4 e→ 4 OH-
W elktrolicie: NaCl →Na+ + Cl-
W elektrolicia zaszły również reakcje powstawania rdzy:
2OH- + Fe2+ → Fe(OH)2
2Fe(OH)2 + O2 + (n-2)H2O → Fe2O3 . n H2O
b) Na płytce, w miejscu, gdzie nanieśliśmy kroplę, powstało ogniwo stężeniowe w skutek czego zaczął przebiegać proces korozji. Na obrzeżach zaszedł proces katodowy:
1/2 O2 + H2O + 2e → 2 OH-
Jony OH- spowodowały malinowe zabarwienie fenoloftaleiny wchodzącej w skład wskaźnika ferroksylowego.
Na anodzie zaszła następująca reakcja:
Fe→Fe2+ + 2e
Z kolei w elektrolicie doszło do wytrącenia rdzy wg reakcji:
2OH- + Fe2+ → Fe(OH)2
2Fe(OH)2 + O2 + (n-2)H2O → Fe2O3 . n H2O
W miejscu, gdzie spotykały się jony Fe2+ i OH- między anodą a katodą w strefie pośredniej strącał się osad, co prowadziło do powstawania zaobserwowanego brunatnego pierścienia.
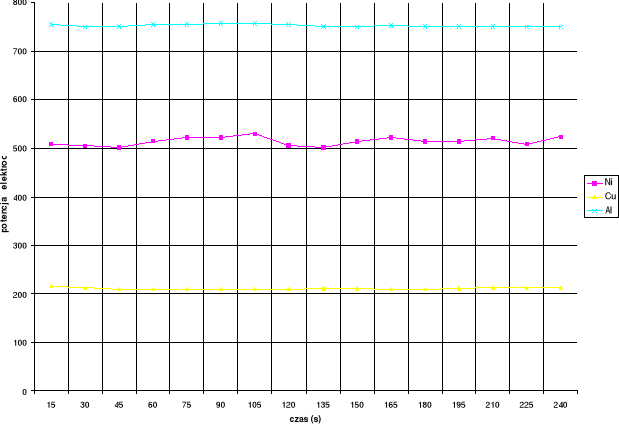
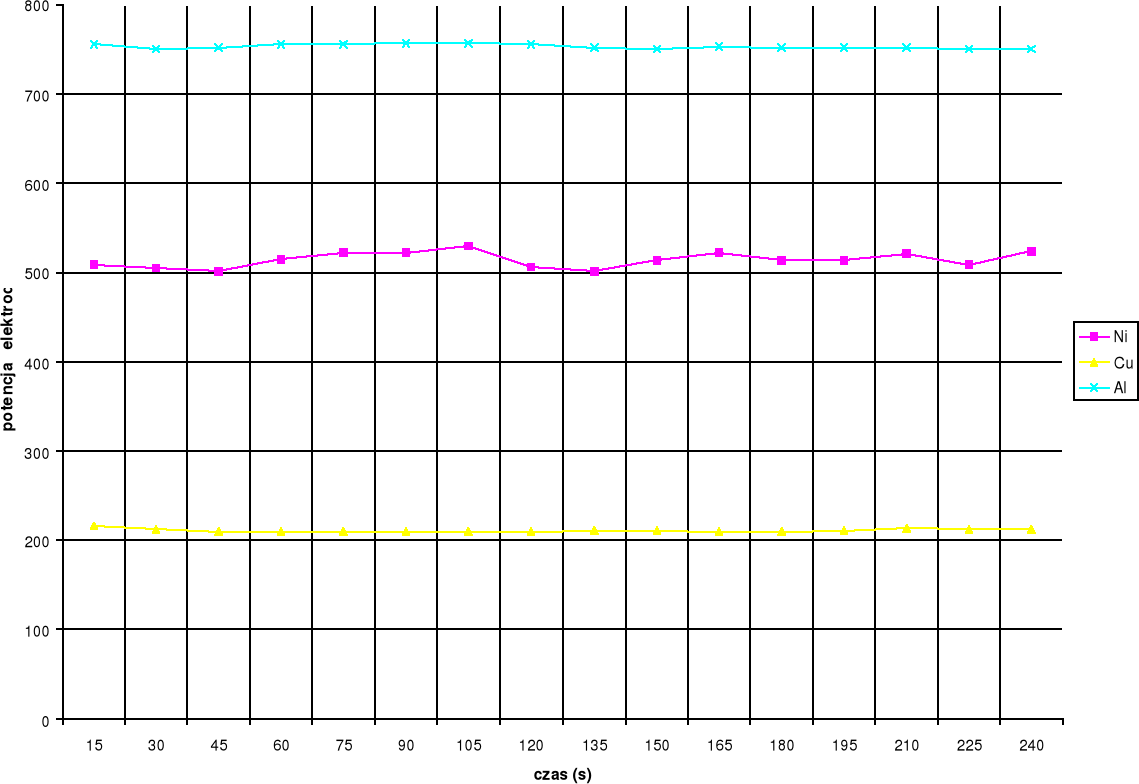
c) po zestawieniu otrzymanych wyników sporządziłem wykres:
Wyszukiwarka
Podobne podstrony:
Projekt z przedmiotu TBM wykonany w programie PROFIL, Maszynoznawstwo
103a Zakres I Forma Dok Projektowej, Spec Tech Wykonania I Odbioru Robót Bud Oraz Programu Funkcj
PROJEKT PRZEDSZKOLNEGO PROGRAMU PROFILATYKI WAD POSTAWY, Przedszkole
103a Zakres I Forma Dok Projektowej, Spec Tech Wykonania I Odbioru Robót Bud Oraz Programu Funkcj
Rozporządzenie w sprawie szczegółowego zakresu i formy dokumentacji projektowej, specyfikacji techni
Ocena efektów programu profilaktyki zaburzeń odżywiania, Medycyna, Anoreksja, bulimia, ortoreksja
PROGRAM PROFILAKTYCZNY, zajęcia z dziećmi, Dokumenty(1)
program profilaktyczny
Projektowanie oprogramowania Wstep do programowania i techniki komputerowej
Program Profilaktyki(1), psychologia
PROGRAM PROFILAKTYCZNY(1), materiały na UKW, profilaktyka spoleczna, dokumenty różne
Ćwiczenie projektowe z przedmiotu
Projekt z przedmiotu
Szkolny Program Profilaktyki Szkoły Podstawowej im
konspekt PROGRAM PROFILAKTYCZNY
PROJEKT - PRZEDMIAR drogi klasy Z, Ekon. Inż. z Kosztorysowaniem w Drogownictwie
projekt z przedmiotu?dań i organizacji pracy CAB2SFPTEYRO2DIQ7RBQ3N5VZWDIOZVIIN6Z2VI
więcej podobnych podstron