ANALIZA ANIONÓW
Grupa |
Skład |
Tworzenie trudno rozpuszczalnych soli |
|
|
|
Ag+ [AgNO3] |
Ba+ [Ba(NO3)2] |
I |
Cl- ; I- |
+ nierozpuszczalne w HNO3 |
- |
II |
NO2- |
+ rozpuszczalne w HNO3 |
- |
III |
SO32- ; C2O42- ; CO32- |
+ Biały osad rozpuszczalne w HNO3 |
+ Biały osad rozpuszczalne w HNO3 |
IV |
S2O32- ; PO43- |
+ Barwny osad rozpuszczalne w HNO3 |
+ Barwny osad rozpuszczalne w HNO3 |
V |
NO3- |
- |
- |
VI |
SO42- |
- |
+ nierozpuszczalne w HNO3 |
VII |
SiO32- |
+ Żółty osad rozpuszczalne w HNO3* |
+ Biały osad rozpuszczalne w HNO3* |
* - sól rozpuści się ale wytrąci się inny osad
![]()
Analiza Anionów
Etap I
rozpoznanie grupy - potraktowanie próbki roztworami AgNO3 i Ba(NO3)2
Etap II
rozpoznanie wewnątrz grupy
reakcja red-ox:
Reduktor: Cl- ; I- ; SO32- ; C2O42- ; S2O32-
Utleniacz: NO3-
Obojętny: CO32- ; PO43- ; SO42- ; SiO32-
Amforek: NO2-
Grupa I
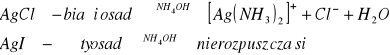
Grupa II
NO2 jako reduktor w reakcji red-ox odbarwia MnO4 (reakcja zachodzi w środowisku kwasowym, przy obecności kwasu H2SO4, ponieważ jest on obojętny)
![]()
NO2 jako utleniacz w reakcji red-ox wytrąca I i ulatnia się NO (reakcja zachodzi w środowisku kwasowym, przy obecności kwasu H2SO4, ponieważ jest on obojętny)
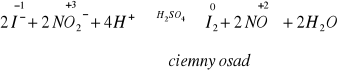
Grupa III
CO3 - nie redukuje i nie utlenia, jest obojętny
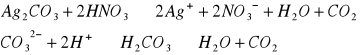
SO32- - silny reduktor, odbarwia MnO4 od razu (reakcja zachodzi w środowisku kwasowym, przy obecności kwasu H2SO4, ponieważ jest on obojętny)
![]()
C2O42- - słaby reduktor, odbarwia MnO4 po podgrzaniu (reakcja zachodzi w środowisku kwasowym, przy obecności kwasu H2SO4, ponieważ jest on obojętny)
![]()
Grupa IV
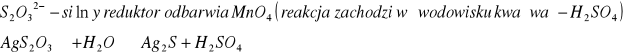
![]()
ma czarny kolor
PO43- - obojętny nie odbarwia MnO4
Grupa V
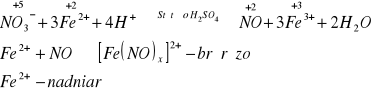
Grupa VI
Jeden Anion
Grupa VII
Patrz „*”
Stężenie Molowe
![]()
Wyszukiwarka
Podobne podstrony:
HIGIENA, CWICZENIE 7, 13 11 201 Nieznany
Higiena mleka, Ćwiczenia (7), Ćwiczenia (7) 13-11-2013
Rachunkowość fiansowa - ćwiczenia (4) 13.11.2010, WSFiZ Białystok - zarządzanie, Semestr III, RACHUN
6 Historia literatury ćwiczenia 13 11 2014
Sprawozdanie ćwiczenie nr 11, Tż, Analiza żywności II, Sprawozdania
Cwiczenie nr 11 Analiza ilościowa (miareczkowa) Oznacznie Ca 2 , Mg 2 Twardosc
Cwiczenia 13 Podstawy analizy bialek
MIKROEKONOMIA ĆWICZENIA 3 i 4 (12 13 11 2011)
13 11 2013 Nasiennictwo ćwiczenia
Ćwiczenie 5 Wykład Białko całkowite 13 11
Ćwiczenia puszki 2 10 13 11 14 całość na 1 koło
13 11
psychozy alkoholowe 13.11.2005, Studia, Psychoprofilaktyka
więcej podobnych podstron