24.10.2001 Szczecin
Rat. „A” Michał Maksimczuk
Krzysztof Nagórski
Sprawozdanie
Temat: Dysocjacja elektrolityczna
I. CEL DOŚWIADCZEŃ
Celem doświadczeń jest zbadanie wpływu czynników zewnętrznych na szybkość reakcji chemicznych.
II. DEFINICJE
Stopień dysocjacji - elektrolitycznej α wyraża stosunek stężenia cząsteczek zdysocjowanych do początkowego stężenia elektrolitu w roztworze. Stopień dysocjacji jest odwrotnie proporcjonalny do stężenia i w rozcieńczeniu nieskończenie wielkim zbliża się do 100%. Jest on również zależny od temperatury i rośnie wraz z jej wzrostem.
Stała równowagi - wyrażona za pomocą stosunku stężeń, zależy tylko od temperatury, z tego też względu dla określonej dysocjacji. Im wyższa wartość KC, tym silniejszy jest elektrolit.
Prawo rozcieńczeń - [prawo Ostwald'a] stopień dysocjacji jest odwrotnie proporcjonalny do pierwiastka kwadratowego z początkowego stężenia elektrolitu.
Własności kwasowe - elektrolitu związane są z obecnością nadmiarem jonów wodorowych, zasadowe - z nadmiarem jonów hydroksylowych w roztworze. W zależności od liczby jonów dysocjujących z cząsteczki, kwasy dzielimy na: jedno-, dwu- i wieloprotonowe, a zasady na: jedno-, dwu-, i wielohydroksylowe. Każdemu stopniowi dysocjacji elektrolitycznej odpowiada określona wartość stałej dysocjacji. Szczególne miejsce zajmują elektrolity amfoteryczne, takie jak: H2O, Be(OH)2, Zn(OH)2, Al(OH)2, Sn(OH)2, Pb(OH)2, As(OH)3, Sb(OH)3, Ga(OH)3, In(OH)3 i wiele innych. Wymienione elektrolity mogą dysocjować jako kwasy i jako zasady, dlatego w ich roztworach wodnych ustala się złożona równowaga, którą można przedstawić w uproszczonej formie.
III. DOŚWIADCZENIA
Substraty: chlorek miedzi (II) CuCl2, aceton CH3COOH3, chlorek kobaltu (II) CoCl2, stężony kwas solny HCl, siarczan (VI) żelaza (III) Fe2(SO4)3, tiocyjanian potasu KSCN, azotan (V) ołowiu (II) Pb(NO3)2, octan ołowiu (CH3COO)2Pb, chlorek ołowiu (III) PbCl2, kwas siarkowy H2SO4, siarczan potasowy K2SO4, siarczan amonowy (NH4)2SO4, kwas octowy CH3COOH wodorotlenek amonowy NH4OH, siarczan sodowy Na2SO4.
Doświadczenie 1
Do próbówek wprowadzamy roztwór chlorku miedzi (II). Do jednej dodajemy aceton do zmiany barwy, do drugiej wody destylowanej. Następnie do próbówki z acetonem dodajemy wody destylowanej.
Doświadczenie 2
Do próbówki z roztworem chlorku kobaltu (II) dodajemy kroplami stężony kwas solny rozcieńczając roztwór wodą destylowaną. Obserwujemy zmianę barwy.
Doświadczenie 3
W zlewce mieszamy roztwór siarczanu (VI) żelaza (III) z tiocyjanem potasu. Dodajemy wodę destylowaną mieszając i stawiamy na białym papierze. Rozcieńczamy roztwór wodą destylowaną do zaniku czerwonego zabarwienia. Powstały roztwór dzielimy na dwie części. Do jednej dodajemy roztwór siarczanu (VI) żelaza (III), a do drugiej roztwór tiocyjanu potasowego. Przez cały czas obserwujemy zmianę barwy.
Doświadczenie 4
Do trzech próbówek wprowadzamy:
azotan (V) ołowiu (II) Pb(NO3)2
octan ołowiu (CH3COO)2Pb
chlorek ołowiu (II) PbCl2
Następnie dodajemy do nich kwas siarkowy (VI).
Doświadczenie 5
Do dwóch próbówek zawierających CH3COOH dodajemy oranż metylowy otrzymując roztwór o barwie pomarańczowej. Do pierwszej próbówki dodajemy CH3COONa, przez co roztwór zmienił barwę na lekko żółtą. Obecność wspólnego jonu CH3COO- cofa dysocjację w stronę CH3COOH.
Dysocjacja kwasu octowego:
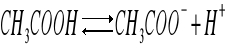
Stała dysocjacji kwasu octowego:
![]()
W części drugiej doświadczenia do drugiej próbówki wprowadzamy NH4OH, który zabarwiamy fenoloftaleiną (kolor malinowy).
IV. OBSERWACJE i WNIOSKI
Doświadczenie 1
Dysocjacja CuCl2 w obecności H2O
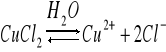
Przebieg reakcji zależy od stałej dielektrycznej rozpuszczalnika ε. Gdy
ε<10 dysocjacja nie zachodzi, a gdy 10<ε<40 dysocjacja zachodzi częściowo, gdy ε>40 dysocjacja zachodzi całkowicie. Następuje tu zmiana barwy z żółtej na niebieską. Natomiast dysocjacja CuCl2 w obecności acetonu zachodzi częściowo. Na dnie znajdują się niebieskie jony Cu2+, a u góry żółte niezdysocjowane CuCl2. Oznacza to, że w obecności acetonu dysocjacja zachodzi częściowo.
Doświadczenie 2
Dysocjacja CoCl2 w obecności H2O:
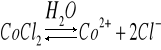
Stała równowagi:
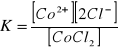
Dodatek wspólnego jonu chloru Cl- cofnął dysocjację. Roztwór zmienił barwę z różowej na niebieską. Nadmiar jonu chlorkowego przesuwa równowagę w stronę zdysocjowanego CoCl2.
Doświadczenie 3
Dysocjacja roztworu Fe(SCN)3:
![]()
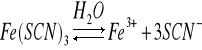
Równanie stałej równowagi
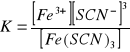
Obecność wspólnego jonu Fe3+ cofnęła dysocjację na stronę Fe(SCN)3. W danym przypadku dodano SCN. Miało to taki sam wpływ jak w pierwszym przypadku - dysocjacja została cofnięta.
Doświadczenie 4
Do trzech probówek wprowadziliśmy następujące związki Pb(NO3)2, (CH3COO)2Pb oraz PbCl2.Następnie kolejno do każdej z nich nalaliśmy kwasu siarkowego ( po dwie krople). W pierwszej probówce roztwór zmienił konsystencje i wydzielił się z niego osad. W drugiej także wydzielił się osad, to samo, ale z mniejszą intensywnością zaszło w trzeciej probówce
1) Pb(NO3)2 + H2SO4 → 2HNO3 + ↓PbSO4
Zmętnienie - wytrącił się mały osad
2) Pb2+ + 2NO3- + SO42- → 2H+ + 2NO3- + PbSO4
Zmętnienie - wytrącił się średni osad
3) (CH3COO)2Pb + H2SO4 → 2CH3COOH + PbSO4
Zmętnienie - wytrącił się osad w małych ilościach
4) 2CH3COO- + Pb2+ + 2H+ + SO42- → 2CH3COO- + H+ + PbSO4
Zmętnienie - wytrącił się osad w dużej ilości
5) PbCl2 + H2SO4 → 2HCl + PbSO4
Zmętnienie - wytrącił się osad w dużej ilości
6) Pb2+ + 2Cl- + 2H+ + SO42- → 2H+ + 2Cl- + PbSO4
Zmętnienie - wytrącił się osad w bardzo dużej ilości
W drugiej części doświadczenia do kolejnych trzech probówek wlaliśmy kolejno Na2So4, K2SO4, (NH4)2SO4. Do każdej z nich dodaliśmy po dwie krople Pb(NO3)2, co spowodowało wytrącenie się osadu w każdej probówce.
Na2SO4 + (CH3COO)2Pb → 2CH3COONa + PbSO4
2Na+ + SO42- + 2 CH3 COO- + Pb2+ → 2CH3COO- + 2Na- + PbSO4
K2SO4 + (CH3COO)2Pb → 2CH3COOK + PbSO4
2K+ + SO42- + 2CH3COO- + Pb2+ → 2CH3COO- + 2K+ + PbSO4
(NH4)2SO4 + (CH3COO)2Pb → 2CH3COONH4 + PbSO4
2NH4+ + SO42- + 2CH3COO- + Pb2+ → 2CH3COO- + 2NH4+ + PbSO4
Doświadczenie 5
Obecność wspólnego jonu CH3COO- cofa dysocjację w stronę CH3COOH.
Dysocjacja kwasu octowego:
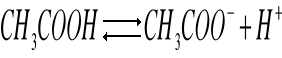
Stała dysocjacji kwasu octowego:
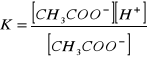
Dodanie do jednej z dwóch próbówek NH4Cl2 spowodowało całkowite odbarwienie roztworu. Także tu obecność wspólnego jonu cofa dysocjację.
Dysocjacja wodorotlenku amonu:
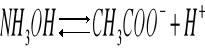
żółty czerwony
niebieski róż bezbarwny
H++Cl-
krwisto czerwony żółty bezbarwny
żółty niebieski bezbarwny
żółty czerwony
żółty czerwony
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, Dysocjacja elektrolityczna, Dysocjacja elektrolityczna-proces rozpadu związków(
Chemia XII Dysocjacja elektrolityczna
Dysocjacja elektrolityczna, AGH WIMiC, Rok II, Chemia Nieograniczna ROK II
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
8.Dysocjacja elektrolityczna - stopień i stała dysocjacji, Chemia ogólna ćwiczenia
Dysocjacja elektrolityczna, Studia, Chemia
Chemia labolatorium, Korozja, Korozja - szkodliwe działanie chemiczne lub elektrochemiczne na powier
Chemia labolatorium, Lepkość, Rat
Dysocjacja elektrolityczna, Chemia
Chemia labolatorium, Pierwiastki grupy s, Pierwiastki grupy s - mają po dwa elektrony na ostatniej p
Chemia labolatorium, Elektroliza, Elektroliza - uszeregowana wędrówka jonów do elektrod pod wpływem
Chemia labolatorium, Fiza, Pierwsze prawo Faradaya Masa M wydzielająca się na elektrodzie jest propo
Dysocjacja elektrolityczna
Jednomodowe czujniki interferencyjne, Studia, sprawozdania, sprawozdania od cewki 2, Dok 2, Dok 2, P
DYSOCJCJA ELEKTROLITYCZNA
07 Dysocjacja elektrolityczna, pH sprawozdanie
więcej podobnych podstron